В физике выделяют 2 скорости, характеризующие движение молекул: средняя скорость движения молекул и средняя квадратичная скорость.
Видео:Урок 152. Среднеквадратичная скорость молекул. Опыт ШтернаСкачать

Средняя скорость движения молекул
Средняя скорость движения молекул называется также скоростью теплового движения молекул.
Формула средней относительной скорости молекул в физике представлена следующим выражением:
» open=» υ o t n = 2 8 k T πm 0 = 2 » open=» υ .
Видео:Измерение скоростей молекул газа | Физика 10 класс #32 | ИнфоурокСкачать

Средняя квадратичная скорость
Средняя квадратичная скорость движения молекул газа это следующая величина:
» open=» υ k υ = 1 N ∑ i = 1 N υ i 2
Формулу средней квадратичной скорости можно переписать так:
» open=» υ k υ 2 = ∫ 0 ∞ υ 2 F υ d υ .
Проводя интегрирование, аналогичное интегрированию при получении связи средней скорости с температурой газа, получаем:
» open=» υ k υ = 3 k T m 0 = 3 R T μ
Именно средняя квадратичная скорость поступательного движения молекул газа входит в состав основного уравнения молекулярно-кинетической теории:
p = 1 3 n m 0 » open=» υ k υ ,
где n = N V – это концентрация частиц вещества, N – это количество частиц вещества, V – это объем.
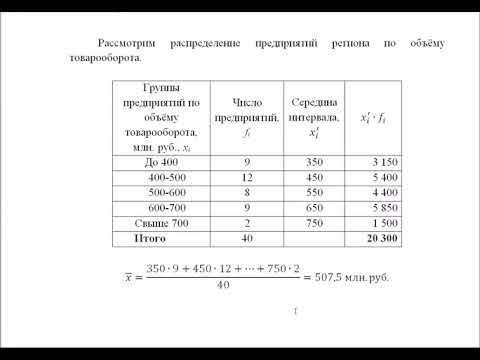
Необходимо определить, как изменяется средняя скорость движения молекул идеального газа с увеличением давления в процессе, изображенном на графике (рисунок 1 ).
Запишем выражение для средней скорости движения молекул газа следующим образом:
» open=» υ = 8 k T πm 0
Из графика видно, что p
ρ или p = C ρ , где C – это некоторая константа.
m 0 = ρ n , p = n k T = C ρ → k T = C ρ n
Подставив m 0 = ρ n , p = n k T = C ρ → k T = C ρ n в » open=» υ = 8 k T πm 0 , получаем:
» open=» υ = 8 k T πm 0 = 8 C ρ π n n ρ = 8 C π
Ответ: В процессе, представленном на графике, с увеличением давления средняя скорость движения молекул не меняется.
Можно ли найти среднюю квадратичную скорость молекулы идеального газа, если известно: давление газа ( p ) , молярная масса газа ( μ ) , а также концентрация молекул газа ( n ) ?
Применим выражение для » open=» υ k υ :
» open=» υ k υ = 3 R T μ
Помимо этого, из уравнения Менделеева-Клайперона и зная, что m μ = N N A :
p V = m μ R T = N N A R T .
Поделим правую и левую части p V = m μ R T = N N A R T на V , и зная N V = n , получаем:
p = n N A R T → R T = p N A n
Подставляем p = n N A R T → R T = p N A n в выражение для среднеквадратичной скорости » open=» υ k υ = 3 R T μ , получаем:
» open=» υ k υ = 3 p N A μ n
Ответ: По заданным в условии задачи параметрам среднеквадратичная скорость движения молекул газа вычисляется при помощи формулы » open=» υ k υ = 3 p N A μ n .
Видео:Урок 153. Распределение молекул по скоростямСкачать

3.3. Характерные скорости молекул
В этом разделе приводятся некоторые следствия, вытекающие из формул ( 3.29 

Рис. 3.3. Распределение молекул кислорода по скоростям при разных температурах T1 = 300 К и T2 = 1 300 К
Наиболее вероятная скорость. При бесконечно малых и неограниченно больших значениях скоростей функция распределения стремится к нулю
то есть такие предельные значения скоростей маловероятны в системе. Следовательно, при каком-то значении скорости функция f(v) достигает своего максимума.
Наиболее вероятная скорость vВЕР — это скорость, отвечающая максимальному значению функции распределения.
Ее можно найти, решая уравнение
откуда следует, что
Иными словами, наиболее вероятной называется скорость, вблизи которой на единичный интервал приходится наибольшее число молекул. В этой точке f(v) принимает максимальное значение:
Соотношения (3.31), (3.32) могут быть полезны для анализа изменения функции распределения при изменении температуры газа или при изменении рода газа, то есть массы молекул. Отметим, что как следует из (3.26) – (3.29), распределение Максвелла зависит не отдельно от массы молекул и отдельно от температуры газа, а от их отношения 






С ростом температуры наиболее вероятная скорость vВЕР (3.31) увеличивается, то есть максимум функции f(v) сдвигается вправо (см. рис. 3.3), Т2 > Т1. При этом f(vВЕР) уменьшается, то есть кривая становится более пологой. Так же деформируется кривая, если температура постоянна, но масса молекул уменьшается. Напомним, что при любых деформациях функции распределения f(v) площадь под кривыми постоянна и равна единице в соответствии с формулой ( 3.30 
Относительное количество молекул, скорость которых превышает некоторое значение v0, определяется выражением
На графике (см. рис. 3.3) этому интегралу соответствует лежащая справа от v0 часть площади (отмечена штриховкой), ограниченная кривой f(v) и осью скоростей. Как видно из рис. 3.3, относительное количество молекул, имеющих скорости, превышающие v0, растет с повышением температуры.
В заключение этого раздела заметим, что во всех формулах для функции распределения и характерных скоростей входит отношение массы молекулы к постоянной Больцмана
Умножая числитель и знаменатель на число Авогадро NA и учитывая, что
— молярная масса газа, a
— универсальная газовая постоянная, мы всюду можем использовать это отношение в наиболее удобной для конкретной задачи форме
Распределение молекул по величинам безразмерной скорости. Если при графическом изображении функции распределения Максвелла (3.29) по оси абсцисс откладывать скорости молекул v, то форма кривой и положение максимума будут зависеть от массы молекул и от температуры газа. Но если по горизонтальной оси откладывать отношение скорости к наиболее вероятной скорости, то есть безразмерную скорость
то для всех температур и любых масс молекул (любых газов) получится одна и та же кривая (рис. 3.4).
Рис. 3.4. Распределение Максвелла по величинам безразмерной скорости
Сделав замену переменной
в ( 3.29 
получим распределение Максвелла в форме
Эта формула и соответствующий ей график (см. рис. 3.4) удобны для решения многих задач.
Пример. Найдем, какая часть общего числа молекул кислорода имеет при температуре 27 °С скорости, отличающиеся от наиболее вероятной не более, чем на 1 %; а также скорости в интервале 562–572 м/с.
Произведем необходимые вычисления. Чтобы ответить на первый вопрос задачи, учтем, что u = 1 при v = vВЕР. Величина интервала du = 0,02. Следовательно,
Вычислим наиболее вероятную скорость:
Найдем отношение v = 562 м/с к vВЕР = 395 м/с
Определим по кривой (см. рис. 3.4) значение функции f(u) при u = 1,42. Получаем f(u) = 0,62. Ширина интервала Dv = 10 м/с (Du = 10/395 = 0,0253). Следовательно, доля молекул в этом интервале
Интересно отметить, что молекула кислорода проходит за секунду путь, равный в среднем 0,4 км. Но не нужно забывать о соударениях молекул. Из-за них молекула по прямой движется очень недолго, и ее путь представляет собой ломаную линию. Поэтому молекула, двигаясь с огромной скоростью по отдельным звеньям ломаной траектории, передвигается от слоя к слою газа со сравнительно небольшой скоростью.
Средняя арифметическая скорость. Знание функции распределения молекул по скоростям f(v) дает возможность найти среднее значение скорости, а также любой величины, являющейся функцией скорости, например квадрата скорости v 2 или кинетической энергии молекулы mv 2 /2.
Средняя арифметическая скорость — это отношение суммы абсолютных величин скоростей всех молекул в системе к числу этих молекул.
Разобьем интервал всех возможных значений скорости от 0 до бесконечности на малые интервалы Dvi. Каждому интервалу соответствует количество молекул
Так как интервалы Dvi, малы, то можно приближенно считать скорости молекул данного интервала одинаковыми и равными vi. Сумма значений скоростей молекул интервала
Сумма значений скоростей всех молекул
Разделив эту сумму на число молекул, получим выражение для средней арифметической скорости
Переходя от суммы к интегралу, получаем
Вычисляя интеграл, получаем среднюю арифметическую скорость молекул
Среднеквадратичная скорость. Чтобы найти среднее значение произвольной функции L(v) скорости, нужно эту функцию умножить на функцию распределения и проинтегрировать по всем возможным значениям скорости:
В частности, при L(v) = v отсюда находится .
Среднее значение квадрата скорости равно отношению суммы квадратов скоростей всех молекул системы к общему числу молекул. Таким образом,
Среднеквадратичная скорость — это корень квадратный из среднего значения квадрата скорости молекул
Следует отметить, что характерные скорости отличаются друг от друга лишь численными множителями, причем
а зависимость от Т и m0 (или m) у них одинаковая.
Через среднеквадратичную скорость выражается средняя кинетическая энергия поступательного движения молекул
Этот результат находится в согласии с формулой (1.14) кинетической теории идеальных газов и с законом о равнораспределении энергии, который гласит, что на каждую степень свободы молекулы приходится энергия kBТ/2. Три степени свободы поступательного движения молекулы как раз соответствуют полученному здесь результату (3.44). В сущности, именно для того, чтобы получить такое соответствие, мы выбрали должным образом коэффициент α в ( 3.26 
Эксперимент по проверке распределения Максвелла. Необходимо еще раз подчеркнуть, что установленный Максвеллом закон распределения молекул по скоростям и все вытекающие из него следствия справедливы только для газа, находящегося в равновесии.
Закон справедлив для любого числа молекул N, если только это число достаточно велико. Закон Максвелла — статистический, а законы статистики выполняются тем точнее, чем к большему числу одинаковых объектов они применяются. При малом числе объектов могут наблюдаться значительные отклонения от предсказанной статистики — флуктуации.
Экспериментальное определение распределения скоростей молекул было осуществлено впервые О. Штерном в 1920 г. Исследовалось распределение по скоростям одноатомных молекул паров металлов (Ag или Pt), из которых была изготовлена нить, расположенная на оси двух цилиндров. Нить нагревалась электрическим током, и металл испарялся (см. рис 3.5).
Рис. 3.5 Схема опыта Штерна: 1 — вид установки сбоку; 2 — вид установки сверху
Молекулы, прошедшие через щель во внутреннем цилиндре, летели по прямой и оседали на стенке холодного внешнего цилиндра. Если привести всю установку во вращение (щель все время против точки В0), то молекулы, обладающие большой скоростью v, попадут в некоторую точку вблизи В0, а более медленные затратят на путь больше времени и попадут в точки, отстоящие дальше от В0. Следует обратить внимание, что вылетающие молекулы движутся по прямой, они не участвуют во вращательном движении. Поскольку молекулы в зависимости от скорости попадают в разные точки внешнего цилиндра, то исследуя толщину слоя металла, осевшего на его стенку, можно составить представление о распределении молекул по скоростям.
Найдем распределение молекул по расстояниям S от точки В0 до места их попадания на стенку цилиндра. Если R и r — радиусы большого и малого цилиндров, соответственно (см. рис.), то время полета от щели до стенки цилиндра
За это время цилиндр повернется на угол
где ω — угловая скорость вращения установки. Соответственно, точка попадания будет смещена относительно В0 на расстояние
Подставляя сюда время полета, получаем связь скорости молекулы с расстоянием S:
Подставляя, в свою очередь, полученное выражение в распределение Максвелла и учитывая, что
находим распределение молекул по расстояниям S:
(мы опускаем выражение для нормировочной постоянной С).
Опыты Штерна подтвердили справедливость закона, установленного Максвеллом.
Видео:Рассмотрение темы: "Распределение Максвелла"Скачать

Идеальный газ. Средняя квадратичная скорость
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы введём понятие идеального газа, то есть газа, в котором молекулы не взаимодействуют между собой и не обладают объёмом. Также мы узнаем, что такое средняя квадратичная скорость молекул, микро- и макропараметры, и рассмотрим применение модели идеального газа.
📸 Видео
Физика 10 класс (Урок№18 - Основное уравнение МКТ.)Скачать

Задача на среднюю скоростьСкачать

Распределение Максвелла — Больцмана (часть 6) | Термодинамика | ФизикаСкачать

Урок 154. Задачи на вычисление скорости молекулСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Урок 17 (осн). Задачи на вычисление средней скоростиСкачать

🧬 Молекулярная физика: идеальный газ и изопроцессы с нуля | Физика ЕГЭ 2024 | УмскулСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать

Идеальный газ в молекулярно-кинетической теории | Физика 10 класс #28 | ИнфоурокСкачать

физика 10 класс все формулы и определения, формулы для ЕГЭ по физике, ВПР по физике 10 класс.Скачать

Закон БернуллиСкачать

Вся физика для ОГЭ за 5 часов! | Физика ОГЭ 2023 | УмскулСкачать

Арифметическая прогрессия. Формула n-го члена арифметической прогрессии. 9 класс.Скачать
Идеальный газ Средняя квадратичная скоростьСкачать

Средние величины. Средняя арифметическая.Скачать