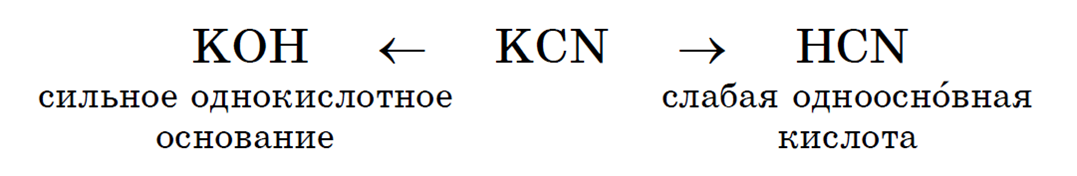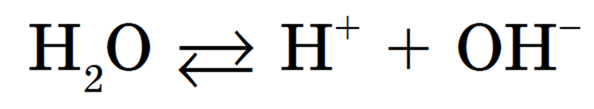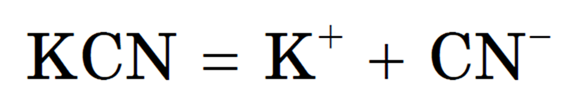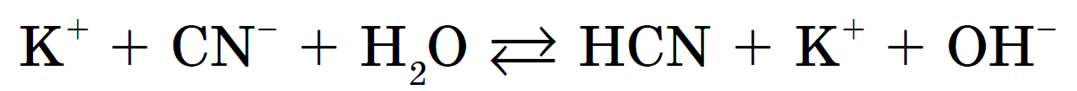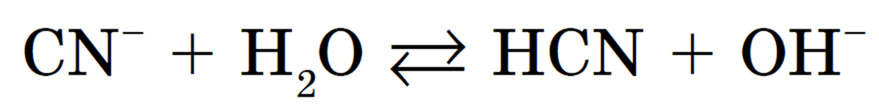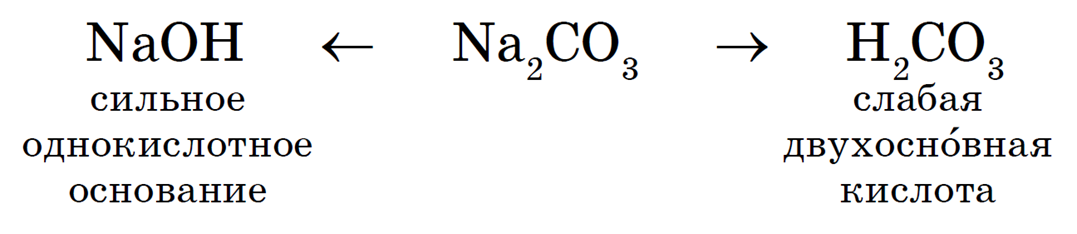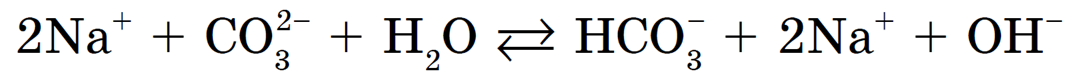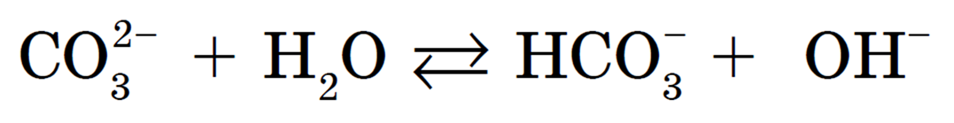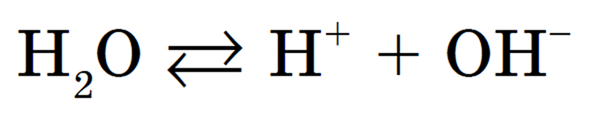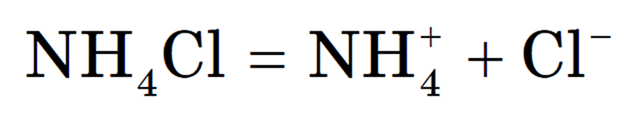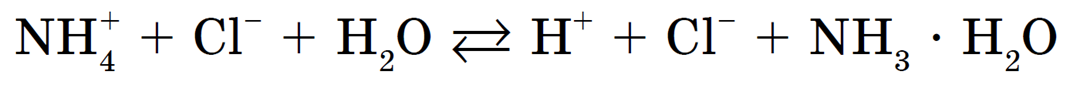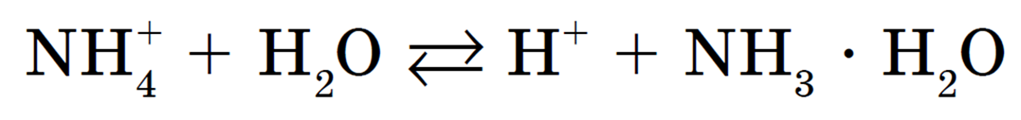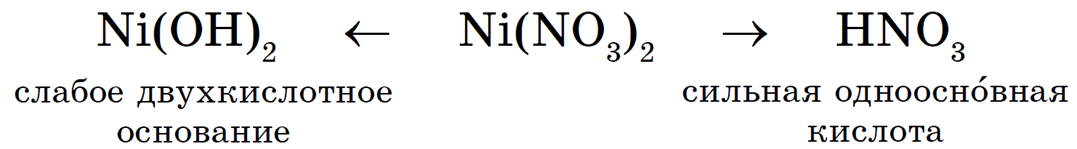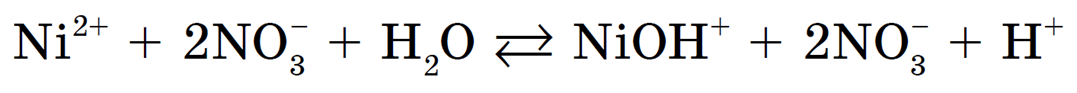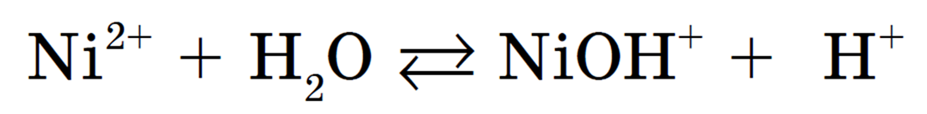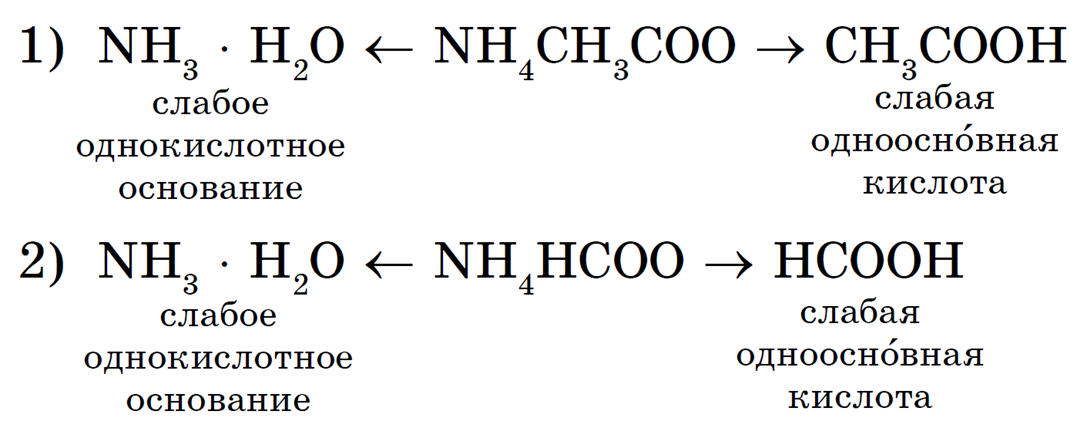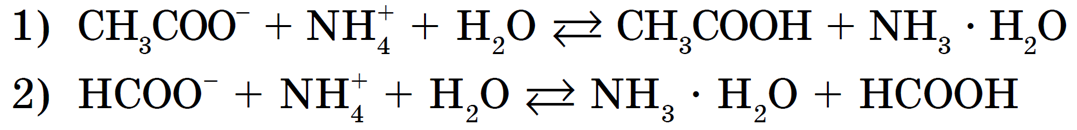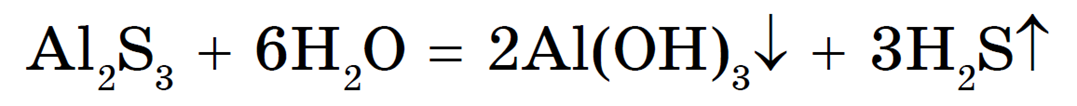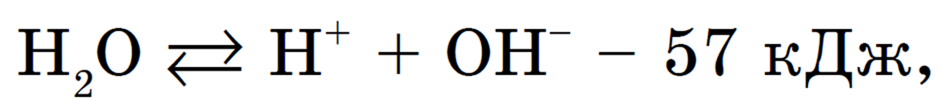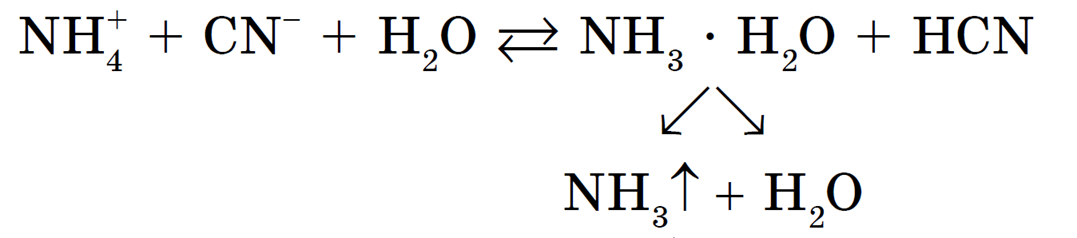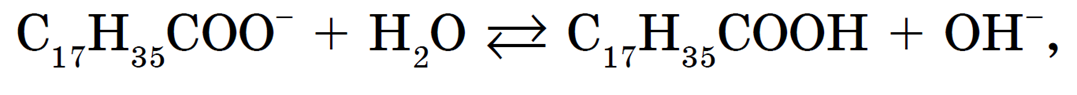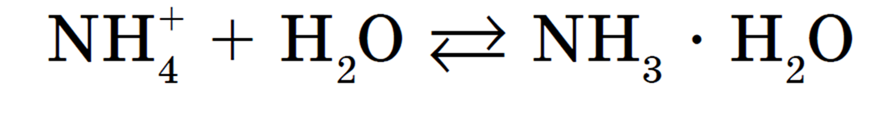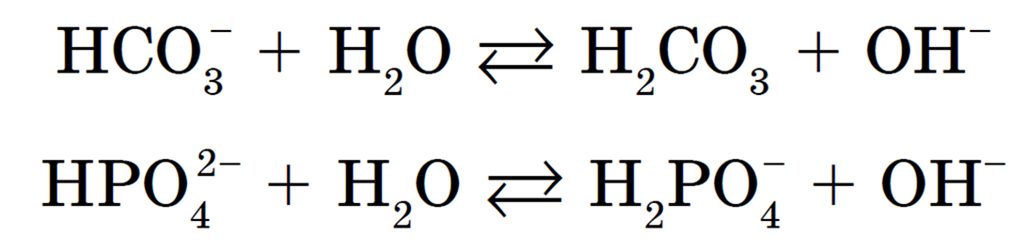Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
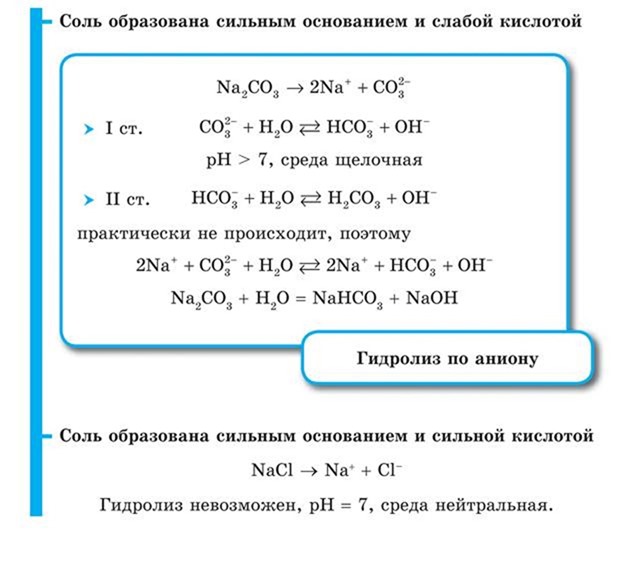
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
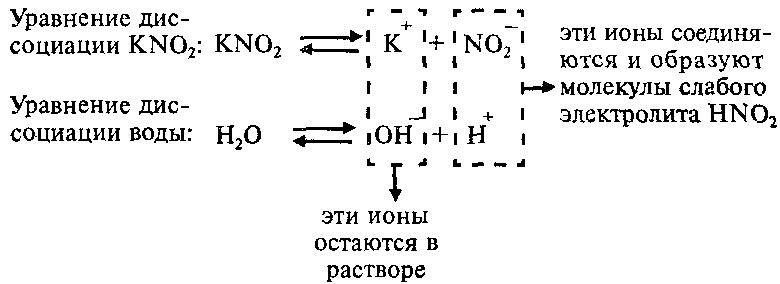
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
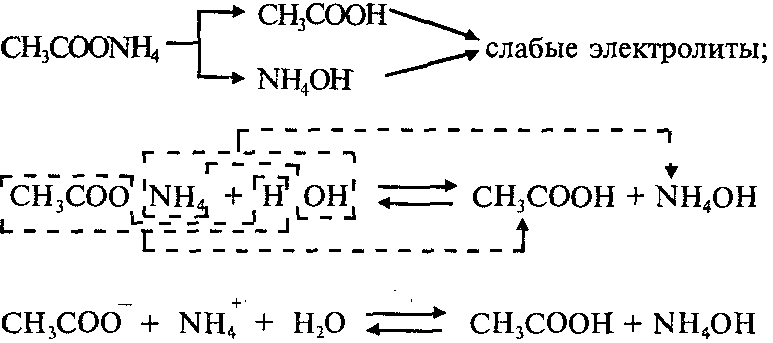
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
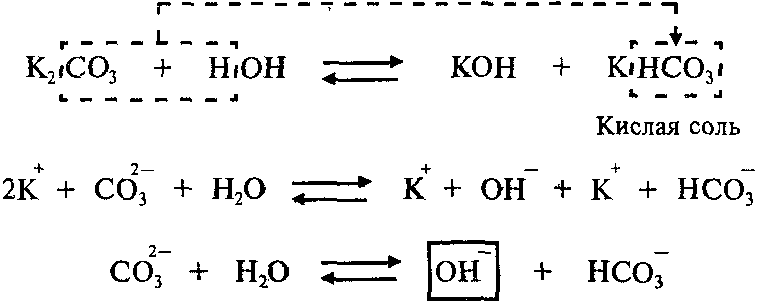
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Видео:Гидролиз солей. 9 класс.Скачать

Тема №36 «Гидролиз солей»
Согласно теории электролитической диссоциации в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз солей
Видео:Как выглядит совместный гидролиз солей на ЕГЭ - химические опыты | Химия 10 класс УмскулСкачать

Оглавление
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакция гидролиза
Согласно теории электролитической диссоциации в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза.
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную (рН 7), нейтральную (рН = 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли становится кислотным или щелочным соответственно.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль KClO образована сильным основанием KOH и слабой кислотой HClO.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия KCN образована сильным основанием KOH и слабой кислотой HCN:
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
2) полная диссоциация соли (сильного электролита):
Образующиеся при этих процессах ионы Н + и CN — взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты HCN, тогда как гидроксид — ион ОН — остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону CN — .
Запишем полное ионное уравнение происходящего процесса (гидролиза):
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т. к. вода — значительно более слабый электролит, чем цианистоводородная кислота HCN:
Уравнение показывает, что:
1) в растворе есть свободные гидроксид-ионы ОН — , и концентрация их больше, чем в чистой воде, поэтому раствор соли KCN имеет щелочную среду (рН > 7);
2) в реакции с водой участвуют ионы CN — , в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов слабых кислот, которые участвуют в реакции с водой:
• муравьиной HCOOH — анион HCOO — ;
• уксусной CH3COOH — анион CH3COO — ;
• сероводородной H2S — анион S 2- ;
Рассмотрим гидролиз карбоната натрия Na2CO3:
Происходит гидролиз соли по аниону CO3 2- . Полное ионное уравнение гидролиза:
Сокращенное ионное уравнение гидролиза:
Продукты гидролиза — кислая соль NaHCO3 и гидроксид натрия NaOH.
Среда водного раствора карбоната натрия — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — . Кислая соль NaHCO3 тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
1) по аниону соли, как правило, гидролизуются обратимо;
2) химическое равновесие в таких реакциях сильно смещено влево;
3) реакция среды в растворах подобных солей щелочная (рН > 7);
4) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония NH4Cl.
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
2) полная диссоциация соли (сильного электролита):
Образующиеся при этом ионы OH — и NH4 взаимодействуют между собой с получением NH3 • H2O (слабый электролит), тогда как ионы Н + остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т. к. вода Н2О — значительно более слабый электролит, чем гидрат аммиака NH3 • H2O.
Сокращенное ионное уравнение гидролиза:
Уравнение показывает, что:
1) в растворе есть свободные ионы водорода Н + , и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (pH + ; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные М 2+ (например, Ni 2 +, Cu 2 +, Zn 2+ …), кроме катионов щелочноземельных металлов, трехзарядные М 3 + (например, Fe 3 +, Al 3 +, Cr 3+ …).
Рассмотрим гидролиз нитрата никеля Ni(NO3)2, гидролиз соли по катиону:
Происходит гидролиз соли по катиону Ni 2+ .
Полное ионное уравнение гидролиза:
Сокращенное ионное уравнение:
Продукты гидролиза — основная соль NiOHNO3 и азотная кислота HNO3.
Среда водного раствора нитрата никеля кислотная (рН + .
Гидролиз соли NiOHNO3 протекает в значительно меньшей степени, и им можно пренебречь. Таким образом:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН — из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы Н + из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов — кислоты и основания, которые образуются в результате гидролиза.
Например, рассмотрим гидролиз двух солей: ацетата аммония NH4CH3COO и формиата аммония NH4HCCO:
В водных растворах этих солей катионы слабого основания NH + взаимодействуют с гидроксид-ионами ОН — (напомним, что вода диссоциирует H2O = H + + OH — ), а анионы слабых кислот CH3COO — и HCOO — взаимодействуют с катионами Н + с образованием молекул слабых кислот — уксусной CH3COOH и муравьиной HCOOH.
Запишем ионные уравнения гидролиза:
В этих случаях гидролиз тоже обратимый, но равновесие смещено в сторону образования продуктов гидролиза — двух слабых электролитов.
В первом случае среда раствора нейтральная (рН = 7), т. к. Kд(CH3COOH) = Kд(NH3 • H2O) = 1,8 • 10 -5 . Во втором случае среда раствора будет слабокислотной (pH -4 и Kд(NH3 • H2O) + связываются образующимися при гидролизе по аниону ионами ОН — . Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, хлорида алюминия AlCl3 и сульфида натрия Na2S.
В результате гидролиза и по катиону, и по аниону:
1) если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующихся основания и кислоты;
2) соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
4. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу.
Рассмотрим «поведение» в растворе хлорида калия KCl.
Соль в водном растворе диссоциирует на ионы (KCl = K + + Cl — ), но при взаимодействии с водой слабый электролит образоваться не может. Среда раствора нейтральная (рН = 7), т. к. концентрации ионов Н + и ОН — в растворе равны, как в чистой воде.
Другими примерами подобных солей могут быть галогениды, нитраты, перхлораты, сульфаты, хроматы и дихроматы щелочных металлов, галогениды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
Следует также отметить, что реакция обратимого гидролиза полностью подчиняется принципу Ле Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
1) добавить воды (уменьшить концентрацию);
2) нагреть раствор, при этом усиливается эндотермическая диссоциация воды:
, а значит, увеличивается количество Н + и ОН — , которые необходимы для осуществления гидролиза соли;
3) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония NH4CN будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака NH3 и воды Н2О:
Гидролиз можно подавить (значительно уменьшить количество подвергающейся гидролизу соли), действуя следующим образом:
1) увеличить концентрацию растворенного вещества;
2) охладить раствор (для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
3) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислотная, или подщелачивать, если щелочная.
Видео:Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать

Значение гидролиза
Гидролиз солей имеет и практическое, и биологическое значение.
Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия K2CO3, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН — .
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые и калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются.
Гидролиз стеарата натрия C17H35COONa выражается следующим ионным уравнением:
т. е. раствор имеет слабощелочную среду.
Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия Na2CO3, карбонат калия K2CO3, бура Na2B4O7 и другие соли, гидролизующиеся по аниону.
Если кислотность почвы недостаточна, у растений появляется болезнь — хлороз. Ее признаки — пожелтение или побеление листьев, отставание в росте и развитии. Если рН > 7,5, то в нее почвы вносят удобрение сульфат аммония (NH4)2SO4, которое способствует повышению кислотности благодаря гидролизу по катиону, проходящему в почве:
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма.
Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды.
Это происходит за счет смещения равновесия процессов гидролиза:
Если в крови избыток ионов Н + , они связываются с гидроксид-ионами ОН — , и равновесие смещается вправо. При избытке гидроксид-ионов ОН — равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Или например: в составе слюны человека есть ионы HPO4 — . Благодаря им в полости рта поддерживается определенная среда (рН = 7-7,5).
Видео:Гидролиз по катиону и аниону. Полный гидролиз. Совместный гидролиз | ХимияСкачать

Шпаргалка
Справочный материал для прохождения тестирования:
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Какие вещества усиливают гидролиз (hydrolysis) хлорида алюминия
Задача 1065.
Добавление каких веществ усилит гидролиз АIСI3: а) H2SO4; б) ZnCl2; в) (NH4)2S; г) Zn?
Решение:
а) АIСI3 – соль сильной кислоты и слабого основания гидролизуется по катиону:
АIСI3 ⇔ Al 3+ + 3Cl − ;
Al 3+ + H2O ⇔ AlOH 2+ + H +
При гидролизе данной соли образуется избыток ионов водорода Н + , поэтому при добавлении к раствору данной соли кислоты H2SO4 создается дополнительный избыток ионов Н + , что, согласно принципу Ле Шателье, приводит к сдвигу равновесия системы влево, т.е. в сторону уменьшения концентрации ионов Н + , гидролиз ослабнет.
б) ZnCl2 – соль сильной кислоты и слабого основания гидролизуется по катиону:
(Zn 2+ + H2O ⇔ ZnOH + + H + ) так же как и АIСI3, поэтому при смешении этих солей в растворе будет наблюдаться увеличение концентрации ионов Н+, что, естественно, согласно принципу Ле Шателье, приводит к сдвигу равновесия системы влево, т.е. в сторону уменьшения концентрации ионов Н + , гидролиз ослабнет.
в) (NH4)2S – соль слабого основания и слабой кислоты гидролизуется как по катиону, так и по аниону:
При гидролизе данной соли образуется избыток как ионов OH − так и ионов Н + , которые связываясь друг с другом образуют молекулы:
Н2О (Н + + OH − ⇔ Н2О). Но, так как K(Н2S) + образуют молекулы воды. Образующийся избыток воды приводит к разбавлению раствора соли, т. е. к уменьшению концентрации продуктов реакции. Поэтому при смешении растворов солей хлорида алюминия и сульфида аммония будет наблюдаться уменьшение концентраций ионов Н + и OH − , что, согласно принципу Ле Шателье будет приводить к сдвигу равновесия в системе вправо, в сторону увеличения концентрации ионов Н + и OH − , т. е. к усилению гидролиза.
г) Zn в ряду напряжений стоит до водорода, поэтому при добавлении его в раствор хлорида алюминия кроме гидролиза соли дополнительно будет происходить связывание его с ионами водорода (Zn + 2H + ⇔ Zn 2+ + H2↑. Таким образом, при прибавлении цинка к раствору хлорида алюминия произойдёт связывание ионов Н + с металлическим цинком, что, согласно принципу Ле Шателье будет приводить к сдвигу равновесия системы вправо, в сторону увеличения ионов Н + , т. е. будет наблюдаться усиление гидролиза AlCl3.
Видео:Опыт: совместный гидролиз солейСкачать

Смешение хлорида алюминия и карбоната натрия
Задача 1066.
Какие продукты образуются при взаимодействии АIСI3 и Na2CO3 в водном растворе: а) А1(OН)3 и СО2; б) А12(СО3)3 и NaС1?
Решение:
АIСI3 – соль сильной кислоты и слабого основания гидролизуется по катиону:
АIСI3 ⇔ Al 3+ + 3Cl − ;
Al 3+ + H2O ⇔ AlOH 2+ + H +
При гидролизе данной соли образуется избыток ионов водорода Н+.
Na2CO3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
При гидролизе данной соли образуется избыток ионов OH − .
При смешении АIСI3 и Na2CO3 произойдёт связывание ионов Н + и OH − с образованием молекул воды (Н + + OH − ⇔ Н2О), что будет способствовать взаимному усилению гидролиза обеих солей. Поэтому гидролиз АIСI3 и Na2CO3 будет протекать до конца. Значит при смешении АIСI3 и Na2CO3 образуется не А12(СО3)3, а Al(OH)3 и будет выделяться СО2:
2 Al 3+ + 3 CO3 2- + H2O ⇔ 2Al(OH)3↓ + 3СО2↑
Ответ: а).
🔍 Видео
Гидролиз солей. Классификация солей. Решение примеров.Скачать

Совместный гидролиз в реакциях ионного обмена: за что?! | Химия ЕГЭ | УмскулСкачать

ХИМИЯ ЕГЭ 2024 Решение задач Совместный гидролиз солей Растворимость Кристаллогидраты Задание 34Скачать

Совместный гидролиз во второй части | Химия ЕГЭ | УмскулСкачать

Химия | Молекулярные и ионные уравненияСкачать

Решаем все задания на гидролиз в ЕГЭСкачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Совместный гидролиз за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

11 класс. Гидролиз солей.Скачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Опыты по химии. Гидролиз солей алюминияСкачать