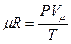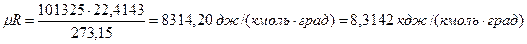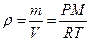Читайте также:
|
| Газ | Химическая формула | Масса 1 кмоль, кг/кмоль | Газовая постоянная R, дж/кг град) | Плотность газа при Нормальных физических условиях, кг/м 3 |
| Кислород | о2 | 259,8 | 1,429 | |
| Водород | н2 | 2,016 | 4124,3 | 0,090 |
| Азот | N2 | 28,02 | 296,8 | 1,250 |
| Окись углерода | СО | 296,8 | 1,250 | |
| Воздух | — | 28,96 | 287,0 | 1,293 |
| Углекислый газ | со2 | 189,9 | 1,977 | |
| Водяной пар | н2о | 18,016 | 461,6 | 0,804 |
| Гелий | Не | 4,003 | 2077,2 | 0,178 |
| Аргон | Аг | 39,944 | 208,2 | 1,784 |
| Аммиак | NH3 | 17,031 | 488,2 | 0,771 |
Выведем основной закон идеальных газов по другому.
Из уравнений [5] и [8] следует, что
Рассмотрим 1 кг газа. Произведение концентрации молекул п, т. е. числа молекул в единице объема, и объема одного моля газа Vмоля равно числу молекул в одном моле, т. е. числу Авогадро N А.. NA = пVмоля .
Вместо двух постоянных: универсальной газовой постоянной R и числа Авогадро NA — была введена постоянная k равная отношению 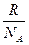
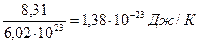
Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
Полученное соотношение представляет собой уравнение Клапейрона (1834г.).
Умножив [11] на m, получим уравнение состояния для произвольной массы газа m:
Используя вес G = mg где g =9.8 м/с 2 PV = GRT [13]
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ.
Положив в (1.10) М = μ, и V = Vμ, получим для одного моля уравнение Клапейрона — Менделеева
Здесь Vμ — объем киломоля газа, а μR— универсальная газовая постоянная — работа, совершаемая 1 кг газа при нагревании его на 1 0 С при Р = const.
В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м 3 , поэтому
μR =PVμ/T =101,325 . 22,4136/273,15 = 8314 Дж/(кмоль . К). [15]
Газовая постоянная 1 кг газа составляет R = 8314/μ ; (1.12)
Плотность идеального газа может быть рассчитана с некоторой степенью точности на основе уравнения состояния идеальных газов
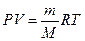
Из уравнения следует
Объем занимаемый единицей массы газа или удельный объем можно определить по уравнению
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Универсальное уравнение состояния идеального газа.
Идеальным газом называется такой газ, у которого отсутствуют силы взаимного притяжения и отталкивания между молекулами и пренебрегают размерами молекул. Все реальные газы при высоких температурах и малых давлениях можно практически считать как идеальные газы.
Уравнение состояния как для идеальных, как и для реальных газов описываются тремя параметрами по уравнению (1.7).
Уравнение состояния идеального газа можно вывести из молекулярно-кинетической теории или из совместного рассмотрения законов Бойля-Мариотта и Гей-Люссака.
Это уравнение было выведено в 1834 г. французким физиком Клапейроном и для 1 кг массы газа имеет вид:
где: R — газовая постоянная и представляет работу 1 кг газа в процессе при постоянном давлении и при изменении температуры на 1 градус.
Уравнение (2.7) называют термическим уравнением состояния или характеристическим уравнением.
Для произвольного количества газа массой m уравнение состояния будет:
В 1874 г. Д.И.Менделеев основываясь на законе Дальтона («В равных объемах разных идеальных газов, находящихся при одинаковых температурах и давлениях, содержится одинаковое количество молекул») предложил универсальное уравнение состояния для 1 кг газа, которую называют уравнением Клапейрона-Менделеева:
где: μ — молярная (молекулярная) масса газа, (кг/кмоль);
Rμ = 8314,20 Дж/кмоль (8,3142 кДж/кмоль) — универсальная газовая постоянная и представляет работу 1 кмоль идеального газа в процессе при постоянном давлении и при изменении температуры на 1 градус.
Зная Rμ можно найти газовую постоянную R = Rμ/μ.
Для произвольной массы газа уравнение Клапейрона-Менделеева будет иметь вид:
Смесь идеальных газов.
Газовой смесью понимается смесь отдельных газов, вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же оюъеме и при той же температуре, что и в смеси.
Газовая смесь подчиняется закону Дальтона:
║Общее давление смеси газов равно сумме парциальных давлений ║отдельных газов, составляющих смесь.
где Р1 , Р2 , Р3 . . . Рn – парциальные давления.
Состав смеси задается объемными, массовыми и мольными долями, которые определяются соответственно по следующим формулам:
где V1 ; V2 ; … Vn ; Vсм –объемы компонентов и смеси;
m1 ; m2 ; … mn ; mсм – массы компонентов и смеси;
ν1 ; ν2 ; … νn ; νсм – количество вещества (киломолей)
компонентов и смеси.
Для идеального газа по закону Дальтона:
Связь между объемными и массовыми долями следующее:
где: μ1 , μ2 , … μn , μсм – молекулярные массы компонентов и смеси.
Молекулярная масса смеси:
Газовая постоянная смеси:
Удельные массовые теплоемкости смеси:
Удельные молярные (молекулярные) теплоемкости смеси:
Тема 3. Второй закон термодинамики.
Основные положения второго закона термодинамики.
Первый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту и не устанавливает условий, при которых возможны эти превращения.
Превращение работы в теплоту происходит всегда полностью и безусловно. Обратный процесс превращения теплоты в работу при непрерывном её переходе возможен только при определенных условиях и не полностью. Теплота сам собой может переходит от более нагретых тел к холодным. Переход теплоты от холодных тел к нагретым сам собой не происходит. Для этого нужно затратить дополнительную энергию.
Таким образом для полного анализа явления и процессов необходимо иметь кроме первого закона термодинамики еще дополнительную закономерность. Этим законом является второй закон термодинамики. Он устанавливает, возможен или невозможен тот или иной процесс, в каком направлении протекает процесс, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу.
Формулировки второго закона термодинамики.
Для существования теплового двигателя необходимы 2 источника – горячий источник и холодный источник (окружающая среда). Если тепловой двигатель работает только от одного источника то он называется вечным двигателем 2-го рода.
1 формулировка (Оствальда):
| «Вечный двигатель 2-го рода невозможен».
Вечный двигатель 1-го рода это тепловой двигатель, у которого L>Q1, где Q1 — подведенная теплота. Первый закон термодинамики «позволяет» возможность создать тепловой двигатель полностью превращающий подведенную теплоту Q1в работу L, т.е. L = Q1. Второй закон накладывает более жесткие ограничения и утверждает, что работа должна быть меньше подведенной теплоты (L 0), то системе подводится тепло.
Если энтропия системы уменьшается (Ds ht . (3.10)
Тема 4. Термодинамические процессы.
📺 Видео
Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Физика. 10 класс. Уравнение состояния идеального газа /23.11.2020/Скачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Уравнение состояния идеального газаСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Уравнение состояния идеального газаСкачать

ЕГЭ по физике. Теория #25. Идеальный газ. Уравнение состояния идеального газаСкачать

ЕГЭ. Физика. Уравнение состояния идеального газа. ПрактикаСкачать

Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

10 класс урок №39 Уравнение состояния идеального газаСкачать

Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Уравнение состояния идеального газа. Газовые законыСкачать


 для 1 кмоль любого газа одинакова и носит название универсальной газовой постоянной.
для 1 кмоль любого газа одинакова и носит название универсальной газовой постоянной.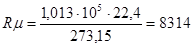 Дж/(кмоль . 0 К)
Дж/(кмоль . 0 К)
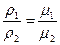
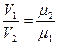 откуда V1μ1 = V2μ2
откуда V1μ1 = V2μ2