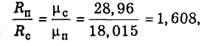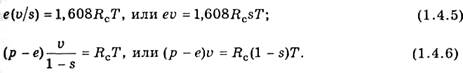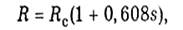Основными характеристиками физического состояния любого газа является плотность, давление и температура. Между этими характеристиками существует связь, которая для идеальных газов выражается уравнением состояния газов
где Р – давление;
V – удельный объем газа V = 1 / ρ.
Т – температура по абсолютной шкале;
R – газовая постоянная;
ρ – плотность газа.
Применяя уравнение состояния газов к сухому воздуху и вводя числовое значение газовой постоянной для сухого воздуха R = 2,87·10 6 см 2 /сек 2 ·град можно получить выражение для плотности сухого воздуха.
Один кубический метр воздуха при t° = 4°С и нормальном давлении имеет массу 1,293 кг. Следовательно, при данных условиях плотность воздуха 1,293 кг/м куб. Это примерно в 800 раз меньше плотности воды.
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Уравнение состояния газов
Основными характеристиками физического состояния газа являются его давление, температура и плотность. Все эти величины взаимозависимы. Газы сжимаемы, поэтому их плотность меняется в зависимости от давления и температуры. Связь между давлением, температурой и плотностью для идеальных газов дается уравнением состояния газов, известным из физики. Оно пишется

где 



Для каждого газа существует температура, называемая критической, выше которой любой газ можно с большой степенью точности назвать идеальным. Если температура газа выше критической, то газ ни при каком давлении не может быть переведен ни в жидкое, ни в твердое состояние.
Идеальный газ, находясь в смеси с другими газами, ведет себя независимо от них, имея собственные давление 


Рассмотрим уравнение состояния газа применительно к сухому воздуху, поскольку он как смесь газов удовлетворяет изложенным выше положениям физики. В табл. 2 приведены значения критической температуры для основных газов, входящих в состав сухого воздуха.
Критическая температура газов, входящих в состав сухой атмосферы
Для сухого воздуха, кроме входящего в него углекислого газа, все газы имеют критическую температуру более низкую, чем температуры, наблюдаемые в земной атмосфере, т.е. сухой воздух можно считать смесью идеальных газов. Углекислый газ в атмосфере имеет очень малое парциальное давление, далекое от насыщающего, т.е. в естественных условиях он также не может сконденсироваться.
Для каждого газа, входящего в атмосферу, можно записать уравнение состояния

где 


Удельная газовая постоянная связана с универсальной R= 8,31441·103 Дж/кмоль·К так:

где 

Общее давление смеси

Принимая массу сухого воздуха равной единице, а массу газа 

где: 
Используя уравнения (1), (4) и (5), запишем


где 

Относительная молекулярная масса сухого воздуха при известном 

Рассмотрим влажный воздух как смесь сухого воздуха и водяного пара. Поскольку критическая температура водяного пара равна 374ºС, он как примесь идеального газа к смеси газов, формирующих сухой воздух, рассматриваться не может. Условие, когда фактическая температура меньше критической, является необходимым, но недостаточным для перехода газа в жидкость или твердое состояние. Необходимо также, чтобы его парциальное давление достигло состояния насыщения. Последнее является только функцией температуры, свойств газа и формы поверхности, для которой она рассчитывается. Здесь будет рассмотрен водяной пар, который до момента насыщения можно считать примесью идеального газа.
Уравнение состояния водяного пара можно представить в следующем виде:

где 



где 
Как показывают экспериментальные исследования и расчеты, в диапазоне температур от 0 до 40ºС удельная постоянная водяного пара 
Для вывода уравнения состояния рассмотрим 1 кг влажного воздуха. В нем содержится q кг водяного пара и 



Сухой воздух и водяной пар равномерно распределены по объему влажного воздуха и полностью его занимают. Удельные объемы водяного пара и сухого воздуха соответственно равны


Если обозначить 



Отношение удельных газовых постоянных водяного пара и сухого воздуха

Заменив удельную газовую постоянную водяного пара удельной газовой постоянной сухого воздуха с соответствующим коэффициентом, получим уравнение состояния влажного воздуха
Множитель (1 + 0,608q) в метеорологии относят к температуре, вводя понятие виртуальной температуры
Она всегда не меньше молекулярной, так как влажность может меняться от 0 до насыщающей.
Таким образом, виртуальная температура – это температура, которую должен иметь сухой воздух, чтобы его плотность при том же давлении была равна плотности влажного воздуха.
Плотность влажного воздуха всегда меньше плотности сухого. В некоторых случаях это может служить дополнительным фактором, способствующим развитию свободной конвекции в атмосфере.
Плотность воздуха в каждом месте непрерывно меняется во времени. Кроме того, она сильно меняется с высотой, потому что с высотой меняются также атмосферное давление и температура воздуха. Давление с высотой всегда уменьшается, а вместе с ним убывает и плотность. Температура с высотой по большей части понижается, по крайней мере в нижних 10-15 кматмосферы. Но падение температуры влечет за собой повышение плотности. В результате совместного влияния изменения давления и температуры плотность с высотой, как правило, понижается, но не так сильно, как давление. В среднем для Европы она равна у земной поверхности 1250 г/м3, на высоте 5 км – 735 г/м3, 10 км – 411 г/м3, 20 км – 87 г/м3.
На высотах около 300 кмплотность воздуха имеет порядок величины 10-8 г/м3, т.е. в сто миллиардов раз меньше, чем у земной поверхности. На высоте 500 км плотность воздуха уже 10-9 г/м3,на высоте 750 км – 10-10 г/м3или еще меньше. Эти значения плотности ничтожны по сравнению с приземными. Но все же до высот более 20 тыс. кмплотность воздуха остается значительно большей, чем плотность вещества в межпланетном пространстве.
Если бы плотность воздуха не менялась с высотой, а оставалась на всех уровнях такой же, как у земной поверхности, то для высоты атмосферы получилась бы величина около 8000 м.В самом деле, приземная плотность сухого воздуха при давлении 760 мми температуре 0° равна 1293 г/м3;столб воздуха с этой плотностью должен был бы иметь высоту, очень близкую к 8000 м,чтобы производить такое же давление, какое производит столб ртути в 760 мм высотой (1033 г/см3).Указанная высота (8000 м)называется высотой однородной атмосферы. В действительности плотность воздуха с высотой убывает, и потому истинная высота атмосферы равняется многим тысячам километров.
Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Уравнение состояния влажного воздуха
Влажный воздух представляет собой механическую смесь сухого воздуха и водяного пара. Поскольку критическая температура водяного пара (Ткр =374 °С) выше наблюдаемых в атмосфере температур, то он в реальных условиях атмосферы может переходить в жидкое и твердое состояния (конденсироваться).
Теория фазовых переходов водяного пара детально рассматривается в разделе IV. Здесь отметим только, что условие Т
Примем следующие обозначения: р — общее давление; Т — температура, одинаковая для водяного пара, сухого и влажного воздуха; е — парциальное давление водяного пара; (р — е) — парциальное давление сухого воздуха. Уравнением состояния водяного пара служит уравнение (1.4.1). Уравнение состояния сухой части воздуха имеет вид
Подставим в уравнения (1.4.1) и (1.4.3) значения удельных объемов в соответствии с (1.4.2) и удельной газовой постоянной водяного пара в соответствии с (1.4.4):
Сложив уравнения (1.4.5) и (1.4.6), получим уравнение состояния влажного воздуха:
которому можно придать два различных вида в зависимости от того, отнесен ли множитель (1 + 0,608s) к удельной газовой постоянной Rc или к температуре Т.
Если ввести удельную газовую постоянную влажного воздуха
то уравнение (1.4.7) примет вид
Удельная газовая постоянная R в этом уравнении — величина переменная, зависящая от влажности воздуха s.
В метеорологии множитель (1 + 0,608s) обычно относят к температуре, вводя понятие виртуальной температуры
Нередко виртуальную температуру представляют в виде суммы:
где ∆Tv — виртуальный добавок. Из сравнения последнего выражения с (1.4.9) следует:
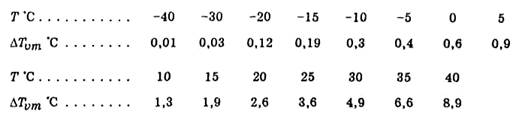
Если водяной пар находится в состоянии насыщения, то ∆Tv при данных Т и р достигает наибольшего значения
которое при фиксированном р является функцией одной лишь температуры. При р = 1000 гПа максимальный виртуальный добавок ∆Tvт имеет следующие значения:
Из этих данных вытекает, что виртуальный добавок, а соответственно и роль влажности в изменении плотности воздуха малы при низких температурах и достаточно велики при высоких.
С введением виртуальной температуры уравнение состояния влажного воздуха принимает вид
Если в (1.4.11) ввести плотность влажного воздуха p = l/v, то уравнение состояния влажного воздуха примет вид
Из сравнения уравнения (1.4.12) с уравнением (1.3.8) следует, что при одинаковых температуре и давлении плотность влажного воздуха всегда меньше плотности сухого воздуха. Физически это объясняется тем, что в состав влажного воздуха входит более легкий по сравнению с сухим воздухом водяной пар, который вытесняет часть сухого воздуха.
📹 Видео
Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Уравнение состояния идеального газаСкачать

идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Уравнение состояния идеального газаСкачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Физика. 10 класс. Уравнение состояния идеального газа /23.11.2020/Скачать

10 класс урок №39 Уравнение состояния идеального газаСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

Газовые законыСкачать

ЧК_МИФ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Урок 194. Уравнение Ван-дер-ВаальсаСкачать

Газовые законы. Изопроцессы | Физика 10 класс #34 | ИнфоурокСкачать