Метан представляет собой простейший предельный углеводород, из которого путем последующих реакций могут быть получены другие органические вещества, в том числе и этилен. Он, как и метан, является простейшим веществом, но, в отличие от него, относится к классу непредельных углеводородов.
Изможно получить ряд сложных органических соединений. Сам он представляет собой бесцветный газ, не имеющий вкуса и запаха, практически нерастворимый в воде, и имеющий меньшую плотность, чем воздух. Он является одним из самых распространенных газов на Земле и других планетах Солнечной системы. При температуре свыше 1000оС метан разлагается до сажи и водорода: CH4→C+2H2.Этот процесс называется крекингом метана. При крекинге другого углеводорода — этана — получается этилен. Поэтому для получения этилена первоначально из метана получают этан, а затем этан подвергают крекингу.
С помощью реакции Вюрца можно получить из соединений метана этан, а затем начать процесс крекинга, в результате чего получится этилен. Эта реакция заключается в том, что к йодистому метилу добавляется металлический натрий, в результате чего получается этан: CH3-Y+[Na]+CH3-Y→C2H6Затем проводится реакция крекинга этана: C2H6→CH2=CH2+CH4+H2 (при t=500оС)
Существует и более современный и простой способ получения этилена из метана. В этом случае, реакцию обычно проводят при температуре 500-900оС в присутствии кислорода и оксидов марганца, кадмия. Затем газы разделяют абсорбцией, глубоким охлаждением и ректификацией под давлением. Уравнение получения этилена из метана выглядит следующим образом: 2CH4→C2H4+H2
Второй способ, ввиду его простоты, применяется чаще. Из этилена, в свою очередь, получают другие органические вещества, в том числе, полиэтилен, уксусную кислоту, этиловый спирт, винилацетат и стирол. В прошлом он также использовался в медицине для наркоза. Кроме того, этилен применяют для регуляции роста растений и созревания плодов. Также из него изготавливают синтетические смазочные масла, которые используются в промышленности и быту.
- Метан: способы получения и свойства
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Бакарабан
- Цепочка реакций Метан — Этилен
- от Admin
- 📽️ Видео
Видео:Реакция этилена с раствором перманганата калияСкачать

Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Реакция Дюма. Получение метанаСкачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Практическая работа №13. Свойства газа этилена. 9 класс.Скачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:получение метанаСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Решение задач на термохимические уравнения. 8 класс.Скачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Видео:Как производят полиэтилен?Скачать  Получение метанаВидео:Взаимодействие этилена с бромной водойСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Горение этиленаСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Получение метанаСкачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:Вся теория по алканам | Химия ЕГЭ для 10 класса | УмскулСкачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  БакарабанТехника и жизнь Видео:Опыты по химии. Получение ацетилена и опыты с нимСкачать  Цепочка реакций Метан — Этиленот AdminЗаписать цепочку уравнений реакций, с помощью которых осуществить превращения: CH4 + Cl2 Этан при н. у. — газ без цвета, не имеет запаха и вкуса, принадлежит группе алканов. Более пожаро- и взрывоопасен, чем метан и пропан. Далее, термическое дегидрирование этана: C2H6 Этиле?н (по ИЮПАК: этен) — соединение с формулой С2H4. При нормальных условиях — горючий газ без цвета со слабым запахом. 📽️ ВидеоПолучение и изучение свойств метана. Опыт 1Скачать  Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать  Получение этилена и его горениеСкачать  2021.05.28 Из метана водород и этилен. Новосибирские химики.Скачать  |
















 CH3Cl+ HCl
CH3Cl+ HCl  C2H6 + 2NaCl
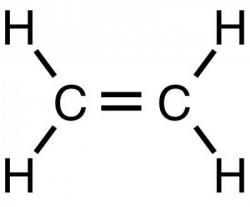
C2H6 + 2NaCl C2H4 + H2
C2H4 + H2