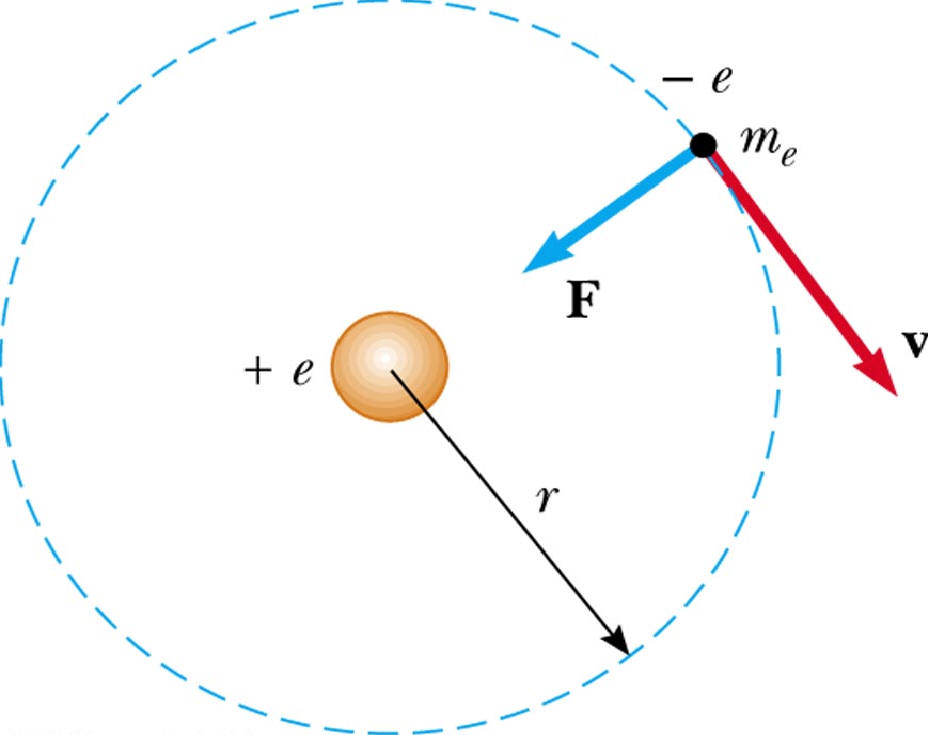
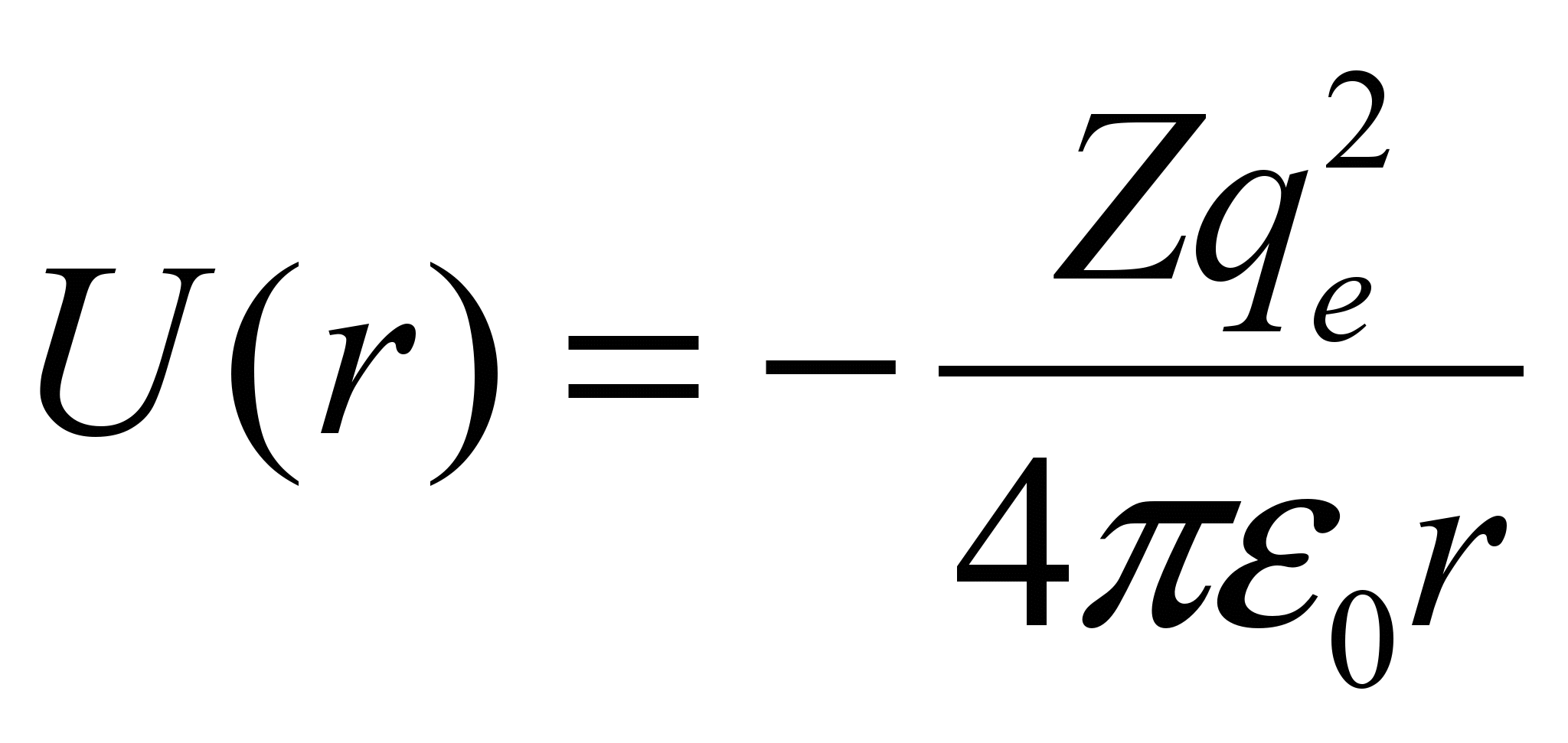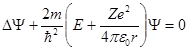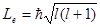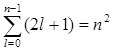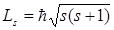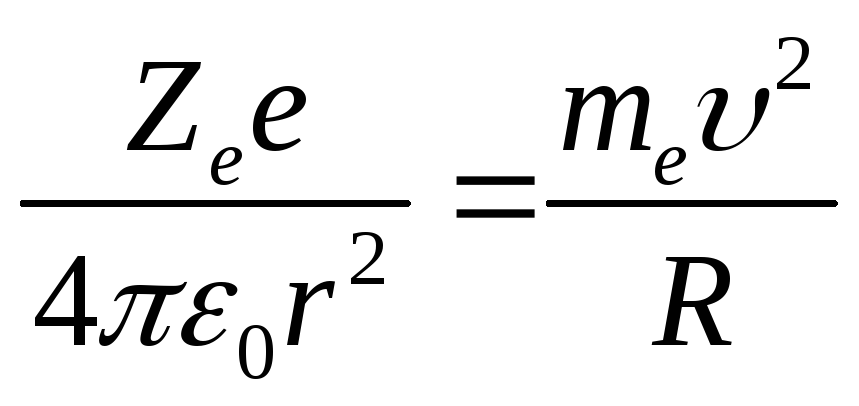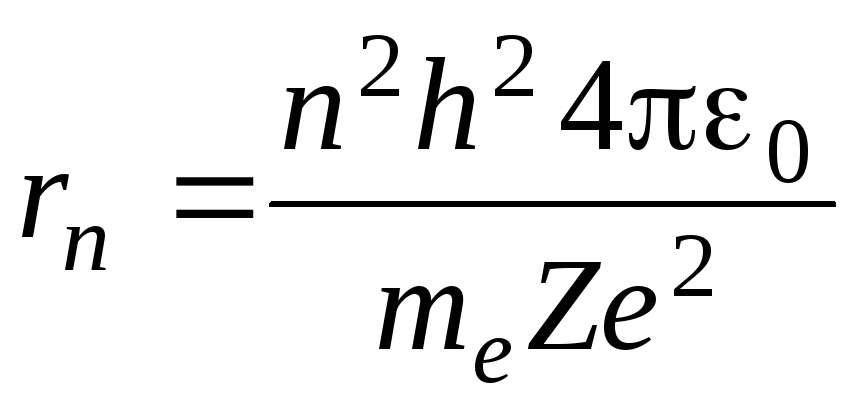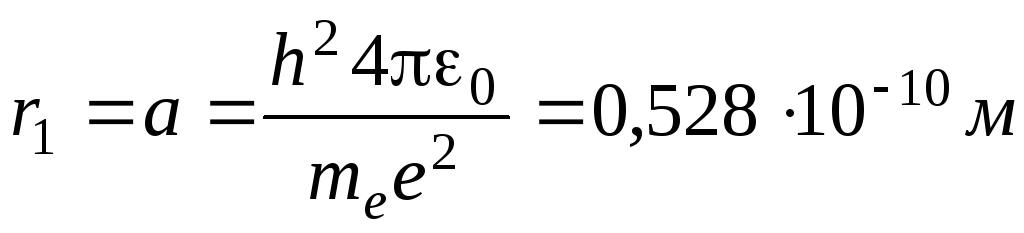Атом водорода и водородоподобные системы – это системы, состоящие из ядра с зарядом Ze и одного электрона (например, ионы He + , Li 2+ ).
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не + , двукратно ионизованного лития Li + + и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Zе (для атома водорода Z =1):
Состояние электрона в атоме водорода описывается волновой функцией Ψ, удовлетворяющей стационарному уравнению Шредингера
Его решения позволяют определить характеристики ВДПА:
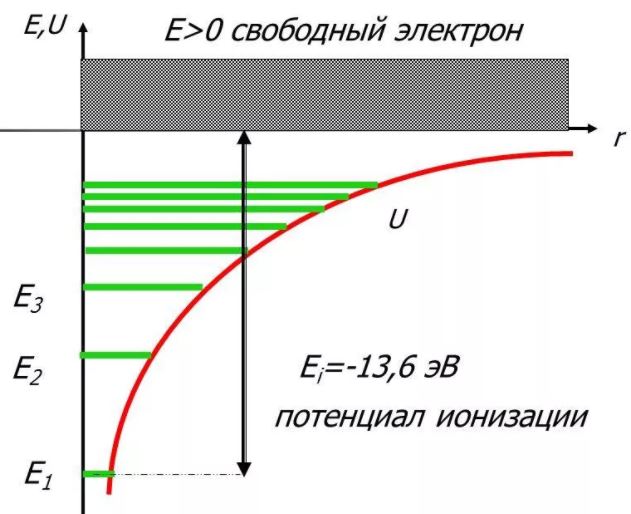
Энергия . В теории дифференциальных уравнений доказывается, что такие уравнения имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции Ψ, только при собственных значениях энергии
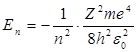
т. е. для дискретного набора отрицательных значений энергии.
Таким образом, как и в случае «потенциальной ямы» с бесконечно высокими «стенками», решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Самый нижний уровень Е1, отвечающий минимальной возможной энергии, – основной, все остальные (Еn>E1, n = 2, 3,…) – возбужденные. При Е 0 движение электрона является свободным; область непрерывного спектра Е >0 соответствует ионизованному атому.
Энергия ионизации атома водорода равна
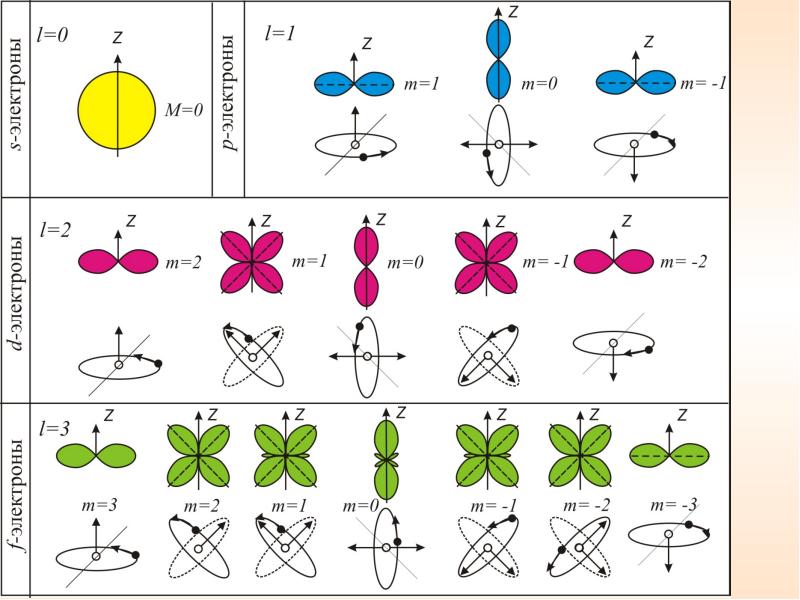
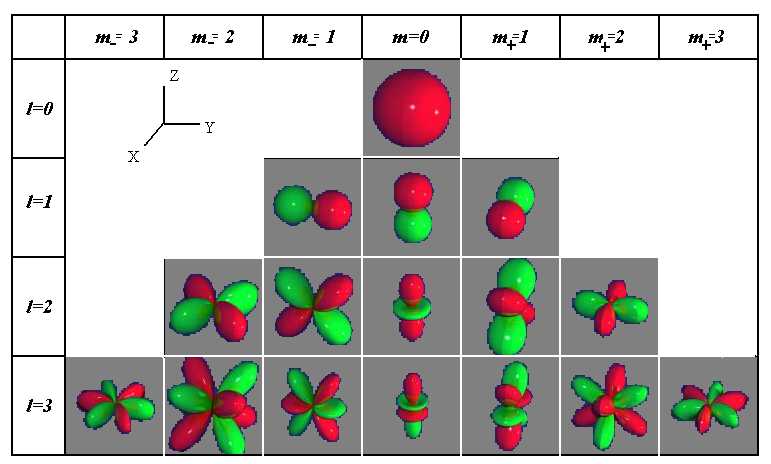
Квантовые числа . В квантовой механике доказывается, что уравнению Шредингера удовлетворяют собственные функции Ψ, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным ml.
Главное квантовое число n, определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы:
Из решения уравнения Шредингера вытекает, что момент импульса (механический и орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
где l – орбитальное квантовое число,которое при заданном n принимает значения
т. е. всего п значений, и определяет момент импульса электрона в атоме.
Из решения уравнений Шредингера следует также, что вектор Le момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Lеz а направление z внешнего магнитного поля принимает квантованные значения, кратные ħ
где тl – магнитное квантовое число,которое при заданном l может принимать значения
т.е. всего 2l+1 значений. Таким образом, магнитное квантовое число тl определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2l + 1 ориентаций.
Так как при данном п орбитальное квантовое число l может изменяться от 0 до n – 1, а каждому значению l соответствует 2l + 1 различных значений тl, то число различных состояний, соответствующих данному n, равно
Опыт Штерна и Герлаха
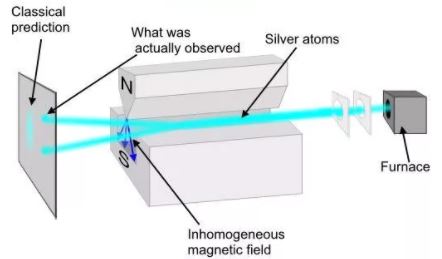
О. Штерном и В. Герлахом были поставлены опыты (1921), целью которых являлось измерение магнитных моментов р m атомов различных химических элементов. Для определения орбитального момента импульса L l и р m одного электрона опыты должны быть поставлены с атомами, у которых орбитальные механические (и магнитные) моменты всех электронов, кроме одного, взаимно компенсируют друг друга. Такими атомами являются атомы химических элементов, образующие первую группу периодической системы Менделеева и имеющие один валентный электрон на внешней оболочке.
Идея опытов Штерна и Герлаха заключалась в измерении силы, действующей на атом в неоднородном магнитном поле. Опыты Штерна и Герлаха обнаружили ошибочность классического предположения отом, что магнитный момент рm и механический момент импульса Ll атома произвольно ориентируются относительно направления внешнего поля, и подтвердили наличие пространcтвенного квантования.
В трубке, где был создан вакуум порядка 10 -5 мм рт. ст., помещался источник пучка атомов — нагреваемый до высокой температуры серебряный шарик К. Атомы серебра вылетали с его поверхности со средней тепловой скоростью порядка 100 м/с, соответствующей температуре испарения серебра. Из этих атомов при помощи щелевых диафрагм В вырезался узкий пучок, проходящий через сильное и неоднородное магнитное поле, направленное перпендикулярно пучку. Основная трудность опыта состояла в том, чтобы достигнуть такой большой неоднородности магнитного поля, которая сказывалась бы на расстояниях порядка размеров атома. При такой величине неоднородности поля можно было рассчитывать получить значительную отклоняющую силу F, действующую на атом в магнитном поле. Необходимая неоднородность поля была достигнута в результате применения сильного электромагнита SN с полюсными наконечниками специальной формы. Приемником атомов серебра служила фотопластинка А.
Если бы момент импульса Ll атома (и его магнитный момент рm ) мог принимать произвольные ориентации в магнитном поле, то можно было бы ожидать непрерывного распределения попаданий атомов на пластинку с большей плотностью попаданий в середине пластинки и меньшей плотностью к ее краям. Опыты, проведенные с серебром и атомами других элементов периодической системы, привели к совершенно другому результату. На рисунке показана фотография результата опыта Штерна и Герлаха с литием. Из рисунка видно, что на фотопластинке получились две резкие полосы — все атомы отклонялись в магнитном поле двояко, что соответствовало лишь двум возможным ориентациям магнитного момента во внешнем поле. Момент импульса атома (и его магнитный момент) равен суммарным моментам электронов, поскольку магнитные моменты ядер имеют значительно меньшее значение, чем магнитные моменты электронов. Последние совпадают с суммарными моментами валентных электронов, так как моменты электронов замкнутых оболочек компенсируются.
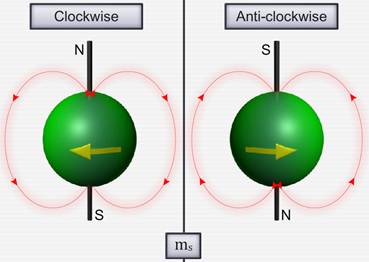
Для объяснения этого американские физики Д. Уленбек (1900- 1974) и С. Гаудсмит (1902-1979) предположили, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве — спином.
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls, то ему соответствует собственный (спиновый) магнитный момент рms,. Согласно общим выводам квантовой механики, спин квантуется по закону
где s – спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz, спина квантуется так, что вектор Ls, может принимать 2s + 1 ориентаций. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s + 1 = 2, откуда s = 1 / 2. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением
где ms – магнитное спиновое квантовое число; оно может иметь только два значения: ms = ± ½.
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состоянии электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
Движение электрона в атоме водорода по круговой орбите радиусом r описывается уравнением:
Найдем радиус n-орбиты:
Для атома водорода радиус первой орбиты электрона (первый боровский радиус) равен
Принцип запрета Паули
Если перейти от рассмотрения движения одной микрочастицы (одного электрона) к многоэлектронным системам, то проявляются особые свойства, не имеющие аналога в классической физике. Пусть квантово-механическая система состоит из одинаковых частиц, например электронов. Все электроны имеют одинаковые физические свойства – массу, электрический заряд, спин и др. внутренние характеристики (например, квантовые числа). Такие частицы называют тождественными, которые невозможно экспериментально различить тождественные частицы.
В классической механике даже одинаковые частицы можно различить но положению в пространстве и импульсам. Если частицы в какой-то момент времени пронумеровать, то в следующие моменты времени можно проследить за траекторией любой из них. Классические частицы, таким образом, обладают индивидуальностью.
В квантовой механике положение иное. Из соотношения неопределенностей вытекает, что для микрочастиц вообще неприменимо понятие траектории; состояние микрочастицы описывается волновой функцией, позволяющей вычислять лишь вероятность (|Ψ| 2 ) нахождения микрочастицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то разговор о том, какая частица находится в данной области, лишен смысла: можно лишь говорить о вероятности нахождения в данной области одной из тождественных частиц. Таким образом, в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми.
Принцип неразличимости тождественных частиц ведет к определенному свойству симметрии волновой функции. Если при перемене частиц местами волновая функция не меняет знака, то она называется симметричной,если меняет антисимметричной.Изменение знака волновой функции не означает изменения состояния, так как физический смысл имеет лишь квадрат модуля волновой функции. В квантовой механике доказывается, что характер симметрии волновой функции не меняется со временем.
Установлено, что симметрия или антисимметрия волновых функций определяется спином частиц. В зависимости от характера симметрии все элементарные частицы и построенные из них системы (атомы, молекулы) делятся на два класса.
Частицы с полуцелым спином (например, электроны, протоны, нейтроны) описываются антисимметричными волновыми функциями и подчиняются статистике Ферми – Дирака; эти частицы называются фермионами.
Частицы с нулевым или целочисленным спином (например, π-мезоны, фотоны) описываются симметричными волновыми функциями и подчиняются статистике Бозе – Эйнштейна; эти частицы называются бозонами.
Сложные частицы (например, атомные ядра), составленные из нечетного числа фермионов, являются фермионами (суммарный спин – полуцелый), а из четного бозонами (суммарный спин целый).
Зависимость характера симметрии волновых функций системы тождественных частиц от спина частиц теоретически обоснована швейцарским физиком В. Паули (1900—1958), что явилось еще одним доказательством того, что спин является фундаментальной характеристикой микрочастиц.
Квантово-механическая формулировка принципа Паули:
Два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной.
Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно принципу, данному п соответствует п 2 различных состояний электронов, отличающихся значениями l и тl. Квантовое число ms, может принимать лишь два значения (±1/2). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой.
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до п – 1, число подоболочек равно порядковому номеру п оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в под оболочке с данным l равно 2 (2l+ 1).
Многоэлектронный атом
В многоэлектронном атоме, заряд которого равен Ze, электроны будут занимать различные «орбиты» (оболочки). При движении вокруг ядра Z‑электроны располагаются в соответствии с квантово‑механическим законом, который называется принципом Паули (1925 г.). Он формулируется так:
1. В любом атоме не может быть двух одинаковых электронов, определяемых набором четырех квантовых чисел: главного n, орбитального /, магнитногоm и магнитного спиновогоms.
2. В состояниях с определенным значением могут находиться в атоме не более 2n 2 электронов.
Значит, на первой оболочке («орбите») могут находиться только 2 электрона, на второй – 8, на третьей – 18 и т. д.
Таким образом, совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой . В каждой из оболочек электроны располагаются по подоболочкам, которые соответствуют определенному значению /. Так как орбитальное квантовое число l принимает значения от 0 до (n – 1), число подоболочек равно порядковому номеру оболочки п. Количество электронов в подоболочке определяется магнитным квантовым числом ml и магнитным спиновым числом ms.
Видео:Квантовые числа. 1 часть. 10 класс.Скачать

5.3. Атом водорода
Стационарное уравнение Шредингера для водородоподобного атома (один электрон около ядра с зарядом Ze) имеет вид
Это уравнение удобно записать в сферических координатах:
Разумеется, мы не станем решать это уравнение, но просто внимательно на него посмотрим.
Заметим, что та часть уравнения (5.6), которая зависит от углов, входит только в состав оператора квадрата момента импульса (5.3). Довольно ясен физический смысл этого члена. Представим себе, что в поле центральных сил по орбите радиусом r движется классическая частица с импульсом 
где 

кинетическую энергию «ортогонального» движения. Ее можно выразить через квадрат момента количества движения:
Этот член добавляется к потенциальной энергии кулоновского притяжения к ядру, и его можно интерпретировать как потенциальную энергию в поле центробежных сил. Действительно, если 
В конечном выражении легко узнать известную из классической механики формулу для центробежной силы. Квантовая механика, как это и должно быть, воспроизводит на новом уровне результаты классической: теперь момент импульса стал оператором, но вошел на прежних правах в выражение для оператора полной энергии (гамильтониана).
Любой оператор коммутирует сам с собой, и так как оператор квадрата момента (5.3) вообще не зависит от радиальной переменной r, то
коммутирует с гамильтонианом (5.6). Кроме того, оператор проекции момента импульса
и, стало быть, с гамильтонианом. Следовательно, выполняются классические законы сохранения квадрата и одной проекции момента импульса. Эти законы сохранения справедливы для любого центрально-симметричного поля: специфика кулоновского взаимодействия пока нами не использовалась. Поэтому проекция и квадрат момента могут быть определены одновременно с энергией, и волновая функция стационарного состояния будет зависеть от квантовых чисел l и m. Однако в уравнении Шредингера (5.6) гамильтониан вовсе не зависит от оператора проекции момента импульса. Это значит, что энергия состояния не будет зависеть от магнитного квантового числа m. Иными словами, в любом центрально-симметричном поле имеется вырождение по n, кратность которого равна 21 + 1. Мы уже знаем, что источником вырождения должна служить та или иная симметрия. В классической физике движение частицы в центрально-симметричном поле всегда происходит по орбите, лежащей в одной плоскости. Но сама эта плоскость может быть произвольной в зависимости от начального положения и скорости частицы. Ясно, что значение полной энергии частицы не зависит при этом от ориентации плоскости орбиты в пространстве. Это и есть искомая симметрия, приводящая к вырождению по магнитному квантовому числу.
В кулоновском поле (равно как и в гравитационном) имеется еще одно специфическое вырождение, приводящее к тому, что энергия системы не зависит и от квантового числа l.
Вспомним опять классическую физику. В кулоновском поле финитное движение частицы совершается только по эллипсу. Возьмем в качестве аналогии искусственный спутник. Поместим его на каком-то расстоянии от Земли (то есть зададим потенциальную энергию) и придадим ему какую-то скорость (зададим кинетическую энергию). Таким образом, мы задали полную энергию спутника. Но определена ли его орбита? Разумеется, нет! При той же полной энергии направление скорости влияет на форму орбиты — от прямой линии (вертикальное падение) при нулевом моменте импульса до окружности максимально возможного радиуса при данной полной энергии. Нулевой момент соответствует чисто радиальным колебаниям сквозь центр притяжения, когда вовсе нет кругового движения, и эллипс вырождается в прямую линию (для спутника такое колебание невозможно, но микрочастицы — иное дело). Максимально возможный момент импульса достигается в обратном случае чисто круговой орбиты, когда совсем нет радиального движения. Важно, что его (максимального момента импульса) величина зависит от полной энергии спутника.
Подчеркнем, что ограничение сверху на возможную величину момента импульса 



Здесь 



или 
Эффективная потенциальная энергия при отличном от нуля моменте импульса L имеет минимум в точке 

Поскольку неравенство 


Если в последнее неравенство подставить боровское выражение (3.3) для энергии водородоподобного иона и выражение (5.5) для квадрата момента, то получим неравенство

которое имеет решение

Здесь n — боровский номер стационарной орбиты, или главное квантовое число (см. ниже). Основанная на решении уравнения Шредингера (5.6) строгая квантовая теория дает тот же результат.
Итак, классическая физика подсказывает нам следующие свойства решений уравнения Шредингера:
Вооружившись знанием классической механики, мы можем смело приступать к изучению квантовой. Теперь станут понятны свойства решений уравнения Шредингера для атома водорода. Его решениями являются волновые функции, нумеруемые тремя квантовыми числами: 


Рис. 5.6. Волновые функции трех первых состояний атома водорода с l = 0
Пример 1. Волновая функция основного состояния электрона в атоме водорода имеет вид
Найдем вероятности 



Вероятность обнаружить электрон в элементе объема dV равна
Так как волновая функция основного состояния не зависит от направления радиуса-вектора 


Теперь надо проинтегрировать вероятность 
Интеграл берется точно, и в результате получаем
Здесь e — основание натурального логарифма. Разность 




Иными словами, с вероятностью более 76% электрон в основном состоянии пребывает на расстоянии не более двух радиусов Бора от ядра.
Пример 2. Найдем электростатический потенциал, создаваемый атомом водорода в основном состоянии.
Возьмем любую точку на расстоянии R от ядра. Электростатический потенциал в ней создается, во-первых, положительным зарядом е ядра и, во-вторых, той частью заряда электрона, которая находится внутри сферы радиусом R. Хорошо известно, что сферически симметричное распределение заряда не создает поля во внутренних областях. Поэтому часть электронного облачка, находящаяся дальше выбранной точки, не внесет вклада в потенциал. Поскольку в уравнении (5.7) вычислена вероятность W(R) нахождения электрона внутри сферы радиусом R, то отрицательный заряд внутри этой сферы равен –eW(R). Поэтому потенциал в точке R, создаваемый эффективным зарядом
На больших расстояниях потенциал (5.8) убывает экспоненциально, то есть гораздо быстрее обычного кулоновского потенциала точечного заряда. Это — так называемый эффект экранировки: отрицательный заряд электрона компенсирует положительный заряд ядра. При
потенциал (5.8) переходит в обычный кулоновский потенциал: мы проникли внутрь электронного облачка, где оно уже не экранирует заряд ядра.
Для энергии из уравнения Шредингера получается в точности такая же формула, что и из теории Бора:
Как видно, энергия действительно не зависит от квантовых чисел l, m. При этом, как следует из свойств решений уравнения (5.6), азимутальное квантовое число l принимает целые значения от 0 до n – 1. И это свойство, угаданное нами на основе классической физики, воспроизвелось в квантовой механике.
Удивительно, как квантовая механика, низвергнувшая столько классических представлений, дает аналогичные результаты там, где в дело вступают свойства симметрии системы. Отсюда вывод: симметрия играет более важную роль, чем конкретные физические законы. Когда-нибудь будут открыты новые законы, которые обобщат и квантовую механику, и все теории, которые ныне находятся на переднем крае науки. Но свойства симметрии системы так или иначе проявят себя.
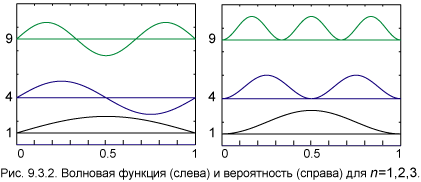
Отличие квантовой механики от теории Бора — более богатая структура состояний: состояние определяется тремя квантовыми числами, как и в трехмерном потенциальном ящике. Кстати, это не случайно. Три квантовых числа в потенциальной яме и в атоме водорода — отражение трехмерности нашего пространства. Подсчитаем кратность вырождения, то есть число различных состояний с одной и той же энергией (главным квантовым числом n). При данном значении n число l пробегает все целые числа от 0 до n – 1, и каждому из них соответствует 2l + 1 значение n. Поэтому кратность вырождения N определяется соотношением
При n = 1 имеем N = 1, то есть основной уровень не вырожден. При n=2 кратность вырождения равна 4: один уровень с l = 0 и три уровня с l = 1 и различными проекциями момента импульса n = –1, 0, +1. При n = 3 кратность вырождения N = 9: один уровень с l = 0, три уровня с l = 1 и пять уровней (по числу проекций) с l = 2. Для классификации состояний энергии по значению квантового числа l применяют условные обозначения, позаимствованные из спектроскопии, где они появились еще до создания теории атома:
Видео:Квантовые числа (видео 14) | Квантовая физика | ФизикаСкачать

Уравнение Шредингера
Вы будете перенаправлены на Автор24
Видео:Урок 459. Обзор квантовой теории атома водородаСкачать

Предпосылки вывода уравнения Шредингера
Основная идея волновой механики заключается в том, что для таких малых тел, как электрон, нельзя с определенностью сказать, где оно находится в данное время и куда направляется. Можно установить только относительную вероятность его нахождения в том или ином месте и наличие определенного количества движения в определенный момент времени.
В соответствии с волновой механикой какая-либо система – атом, молекула, электрон и т.д. – описывается функцией состояния или волновой функцией, обозначаемой $psi$ («пси»), которая является функцией координат всех частиц, образующих эту систему. Следовательно, величина $psi$ зависит только от положения всех частиц в пространстве.
В 1924 г. де Бройль предположил, что точно также, как свет, который, как обычно считают, имеет волновую природу, на самом деле при определенных обстоятельствах ведет себя, как будто он состоит из частиц – квантов, — так и очень малые частицы, такие, как электроны, также могут обладать волновыми свойствами. Де Бройль предположил, что с пучком электронов следует связывать длину волны, определяемую уравнением
где $hbar$ – постоянная Планка ($6,626cdot 1034 Джcdot с$ или $6,626cdot 10-27 эргcdot с$), а $p$ – количество движения (импульс) электрона в пучке, т.е. его масса, умноженная на его скорость.
Физическое подтверждение волновой природы электрона было продемонстрировано в 1927 – 1928 гг. Дейвиссоном, Джермером и Томсоном, которые показали, что пучок электронов может испытывать дифракцию на подходящей решетке (атомы в кристалле золота), аналогичную дифракции пучка света.
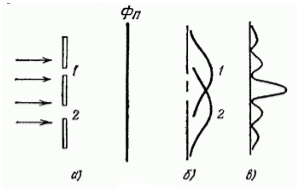
Рисунок 1. Дифракция пучка электронов
На преграду с двумя узкими щелями направлен параллельный пучок моноэнергетических (т.е. обладающих одинаковой кинетической энергией) электронов (рис. 1. а). За преградой находится фотопластина $Фn$. При закрытии щели номер $2$ и экспонировании в течение времени $t$ почернение на проявленной фотопластине будет характеризоваться кривой $1$ (рис. 1. б). При закрытии щели номер $1$, соответственно, почернение на фотопластине будет соответствовать кривой $2$. Однако в случае, когда открыты обе щели картина почернения фотопластины (рис. 1. в) отнюдь не эквивалентна наложению двух первых картин. Зато она аналогична картине, получающейся при интерференции двух когерентных световых волн.
Готовые работы на аналогичную тему
Тот факт, что системы малых частиц проявляют, по крайней мере, при определенных условиях, волновые свойства, предполагает возможность описания таких систем уравнениями, подобными те, которые описывают другие виды волнового движения, например, волны, которые распространяются вдоль колеблющейся струны, или волновое движение, приписываемое электромагнитному излучению. Действительно, можно начать с волнового уравнения, соответствующего электромагнитным волнам, и путем определенных замен, превратить его в уравнение, соответствующее нашему случаю. Хотя эти замены диктуются физическими причинами, они в основном произвольны и могут быть приняты только потому, что приводят к уравнению, которое, как показывает опыт, позволяет получить правильное решение физических задач. Поэтому следует принять волновое уравнение как постулат, так как у химиков основной интерес вызывает применение волнового уравнения к атомным и молекулярным системам, а не физические и математические соображения, которыми руководствовался Шредингер, впервые его предложивший в 1925 г.
Видео:Урок 455. Уравнение ШрёдингераСкачать

Общий вид уравнения Шредингера
Рисунок 2. Эрвин Шрёдингер (1887 — 1961)
Волновое уравнение, применяемое для расчета стационарных состояний системы, можно записать в символическом виде:
где $H$ представляет собой определенный способ выражения общей энергии системы, а $E$ – числовое значение этой энергии. Для всех систем, которые обычно интересуют химиков, общая энергия представляет собой сумму кинетической энергии $Т$ и потенциальной энергии $V$:
Это соотношение было широко использовано физиком-теоретиком Гамильтоном, поэтому $H$ часто называют функцией Гамильтона, а $mathcal H$ гамильтонианом системы.
Видео:Волновая функция (видео 5) | Квантовая физика | ФизикаСкачать
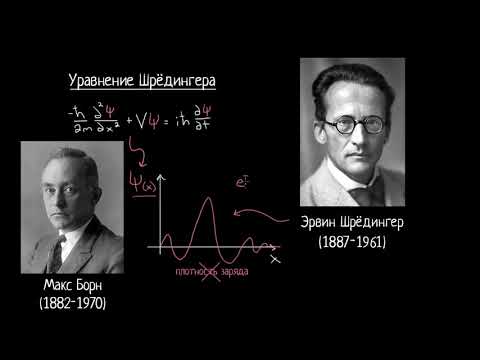
Уравнение Шредингера на примере атома водорода
Рассмотрим модель атома водорода, предложенную Бором. Для простоты предположим, что тяжелое ядро закреплено (оно почти, но не совершенно неподвижно, когда электрон движется вокруг него). Тогда полная кинетическая энергия $Т$ системы представляет собой просто кинетическую энергию электрона
где $m$ – масса электрона и $nu$ – его скорость. Потенциальная энергия системы есть просто энергия, возникающая вследствие электростатического взаимодействия (гравитационные силы приблизительно в $10^$ раз меньше), и ее можно выразить как
где $e$ — заряд электрона, $r$ — радиус орбиты, знак минус появляется вследствие того, что заряд одной из частиц положителен $(+)$, а другой отрицателен $(-)$. Поэтому для атома водорода функция Гамильтона в классической (т.е. доквантовомеханической) физике равна:
Если использовать понятие количества движения электрона $p=mnu$, данное уравнение запишется в следующем виде:
Теперь для перехода от классического описания этой или какой-либо другой системы к описанию при помощи волновой механики, необходимо взять функцию Гамильтона (уравнение 6) и произвести в ней определенные замены: в функции Гамильтона количество движения следует заменить выражением
Таким образом, гамильтониан для атома водорода в его квантовомеханической форме $$ следует записать в виде
Если теперь это выражение гамильтониана подставить в общее волновое уравнение (уравнение 1), то получим:
Это и есть волновое уравнение для атома водорода. Из уравнения 9 следует, что нужно вторые производные функции $psi $ сложить и умножить на $-<^2>/<8^2m>$, затем к этому добавить $left(-/right)psi $, тогда получим величину, тождественную Е$psi $. Если найдена функция $psi $, то говорят, что она является решением волнового уравнения, и ее называют волновой функцией. Вообще, может быть несколько различных функций $psi_1$, $psi_2$, . , $psi_n$, которые являются решениями уравнения 9, причем каждой соответствует свое значение энергии $Е_1$, $Е_2$, . , $Е_n$.
📸 Видео
5.1 Квантовые числаСкачать

Урок 32. Уравнение ШрёдингераСкачать
11. Строение атома. Квантовые числаСкачать

Строение атома: квантовые числаСкачать

Лучшая модель атома? [Минутка физики]Скачать
![Лучшая модель атома? [Минутка физики]](https://i.ytimg.com/vi/eybcxXiYJfc/0.jpg)
ЧК МИФ 5 2 01 01 L4 Уравнение Шредингера для атома водородаСкачать

Квантовые числа. Практическая часть. 10 класс.Скачать

Квантовые числа. Принцип Паули, правило Гунда (Хунда) и правило Клечковского. 2 часть. 10 класс.Скачать

Хренова М.Г. - Квантовая химия - 2. Атом водородаСкачать

Квантовые числа и атомные орбитали. 10 класс.Скачать

Новые темы кодификатора 2022. Квантовые числа | Таисия Фламель | ЕГЭ ХимияСкачать

Консультация по квантовой механике. Часть 6. "Энергетический спектр водородоподобных атомов"Скачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

ВОЛНОВАЯ функция. Уравнение ШРЁДИНГЕРА. КВАНТОВЫЕ ЧИСЛА | КОНДЕНСАТ - ХОХЛОВ Д. Р. ФизФак МГУСкачать

Квантовая физика. Лекция-семинар 8. Решение уравнения Шредингера для атома водорода.Скачать