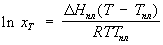Раствор в отличие от чистой жидкости не отвердевает целиком при постоянной температуре; при некоторой температуре, называемой температурой начала кристаллизации, начинают выделяться кристаллы растворителя и по мере кристаллизации температура раствора понижается (поэтому под температурой замерзания раствора всегда понимают именно температуру начала кристаллизации). Рассмотрим случай, когда при охлаждении идеального совершенного раствора кристаллизуется только один компонент — тот компонент, которого больше, т. е. растворитель.
Уравнения, характеризующие это равновесие, имеют вид
Уравнение (5.13) называется уравнением Шредера, оно применимо для идеальных совершенных растворов. Данное уравнение описывает равновесие «жидкость — кристаллы растворителя». Температуру, наблюдаемую при этом, называют температурой кристаллизации, соответственно, температурой кристаллизации чистого растворителя и температурой кристаллизации раствора.
Интегральная форма уравнения Шредера для идеального раствора
Видео:09 Фаз диагр двухкомп сист 3 растворыСкачать

для нсидеального раствора
Закон понижения температуры кристаллизации
где 
Диаграмма плавкости 2-х компонентных систем. Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями
Страницы работы
Содержание работы
19.Диаграмма плавкости 2-х компонентных систем.
Диаграмма плавкости выражает зависимость температур плавления смесей от их состава. Частным случаем диаграмм плавкости являются диаграммы растворимости, представляющие зависимость растворимости твердых веществ в жидкости от температуры.
Состояние двухкомпонентной сист. определяется 3 параметрами (температура, давление и концентрация одного из компонентов)
Видео:09 Фаз диагр двухкомп сист 1 принципы и мех смесьСкачать
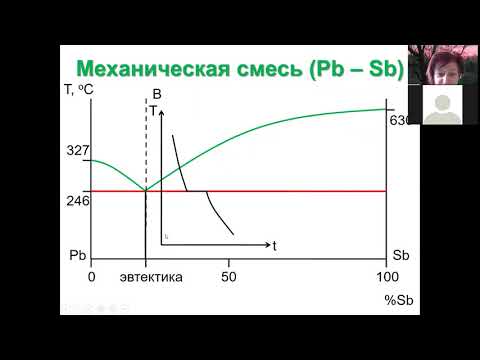
Системы без образования химических соединений
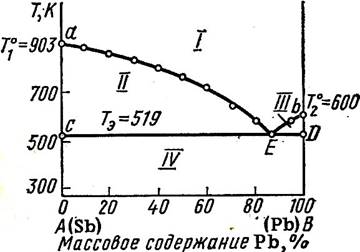
I — жидкий расплав (С=2-1+1=2);
II — жидкий расплав и кристаллы комп-та А (С=
III — жидкий расплав и кристалы
Компонента В (С=2-2+1=1);
Видео:Лекция «Диаграмма состояния двухкомпонентных сплавов»Скачать

IV — кристалы А и В (С=2-2+1=1);
Линия aEb называется линией ликвидуса – составы жидких расплавов, при охлаждении которых до данной температуры начинается кристаллизация из расплава чистого компонента А или В.
Линия СED линией солидуса, ниже нее жидкость не может существовать.
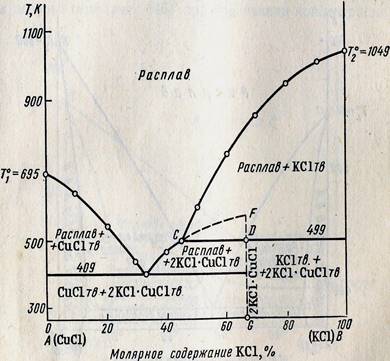
Точка E называется эвтектической точкой – она соответствует расплаву, который одновременно находится в равновесии с кристаллам компонента А и В. Расплав этот называется эвтектическим, а смесь выпадающих кристаллов при Tэ эвтектикой. Эвтектика кристаллизуется при постоянной температуре – система условно инвариантна, т.к. при изменении давления меняется и температура плавления и состав эвтектики. При кристаллизации эвтектики состав жидкого расплава отличается от состава каждой из равновесных с ним твердых фаз.
20(1).Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями.
Видео:Бычков А.Ю. - Физическая геохимия - 6. Диаграммы плавкостиСкачать

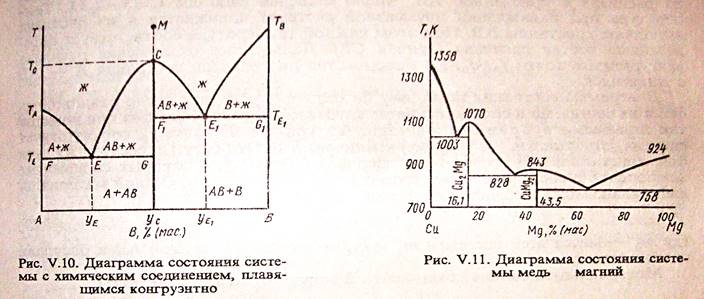
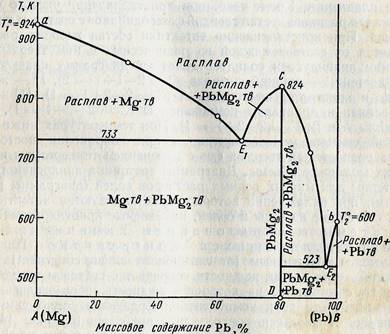
Если компоненты А и В могут образовывать тв. хим. соединение АВ, плавящееся без разложения, т.е. конгруэнтно, то на диаграмме состояния кривая ликвидуса образует максимумы в точке С, когда состав кристаллической фазы совпадает с составом жид. фазы. По обе стороны от точки С нах-ся эвтектики Е и Е1. Если состав системы находится между чистым компонентом А и химическим соединением АВ, то при эвтектической температуре ТЕ, расплав состава уЕ сосуществует с кристаллами А и АВ. Если состав системы лежит между хим. соед. АВ и компонентом В, то при ТЕ1 расплав состава уЕ1 сосуществует с кристаллами АВ и В. Т.о. рассмотренная диаграмма состояния – сочетание 2-х диаграмм состояния с эвтектикой А – АВ и АВ – В.
Процесс охлаждения расплава, заданного точкой М. При этом составе число независимых комп-ов = 1, т.к. система может быть образована только из одного хим. соед. АВ. При ТС из расплава выпадают кристаллы АВ (Ф=2) и число степ. своб. С=1-2+1=0, т.е. система безвариантна и кристаллизуется при постоянной температуре.
Хим. соед-ия при достижении определенной температуры начинают плавиться, распадаясь на кристаллическую и жидкую фазы, составы которых не совпадают. Если компоненты А и В образуют твердое химическое соединение АВ, плавящееся с разложением, т.е. инконгруэнтно, то АВ устойчиво только ниже ТС. При малейшем ↑ t-ры это твердое соединение распадается и образуются 2 фазы: кристаллы В и расплав состава у (точка С).При охлаждении расплава состава М в точке а0 начнется выделение кристаллов компонента В. В интервале температур от а0 до b0 сист. явл. 2-х фазной и одновариантной: С=2-2+1=1. В точке b0при ТС начинается и продолжается кристаллизация соединение АВ, состав которого соответствует у2 (т. D). В равновесии 3 фазы: расплав, кристаллы АВ и В. С=2-3+1=0 – постоянство ТС, состава раствора у (т. С) и состава хим. соединения у2 (т.D).
Чтобы состав расплава не изменялся, одновременно с кристаллизацией АВ ранее выпавшие кристаллы В должны раств-ся, поддерживая постоянным соединение компонента В в расплаве. Т. С наз-ся перитектикой (переходной), ТС — перитектическая температура. В этой точке находятся в равновесии расплав и 2 тверд. фазы, но в отличается от эвтектики, (где одновременно выпадают 2 тв. фазы) одна тв. фаза выпадает, а другая растворяется. На кривой охлаждения наблюдается горизонтальный участок (bb’).
Процесс охлаждения в точке b0 заканчивается растворением всех ранее выпавших кристаллов В. Остается 2-х фазная система, состоящая из расплава и кристаллов АВ. При этом каждой температуре соответствует определенный состав расплава (СЕ). Дальнейшее охлаждение описывается диаграммой состояния А-АВ с эвтектикой.
21. Дифферинциальный термический анализ (ДТА)
Видео:09 Фаз диагр двухкомп сист 2 соединениеСкачать

ДТА – это нахождение зависимости между температурой плавления вещества и его свойствами.Метод позволяет изучать фазовый состав Ме систем, природных минералов, устанавливать тем-ые границы сущ-ия многих соединений (соли, полимеры), определять теплоты фазовых превращений, теплопров-ть, теплоемкость.
Метод основан на автоматической записи дифференциальной термопарой термограмм – кривых ∆Т – Т, где ∆Т – разность температур м/у исследуемым веществом и эталоном, нагреваемых или охлаждаемых в одинаковых условиях; Т – температура образца или время нагревания/охлаждения. Эталон – в-во, не имеющее фазовых превращений в исследуемом интервале температур.
Вид термограммы исследуемого в-ва зависит от свойств самого в-ва (состав, структура, теплопроводность, теплоемкость, дисперсность и др.) и от условий снятия термограммы (скорость нагревания, величина навески, плотность набития в-ва в тигле, положения спая в образце и в эталоне, свойства эталона, чувствительность в цепи дифференциальной термопары).
Шредера уравнение
Шр е дера уравн е ние, математическое соотношение, выражающее связь между растворимостью кристаллического тела xt при температуре Т (в К), его теплотой плавления D Нпл (в кал/моль) и температурой плавления Тпл:
Видео:Диаграмма состояния сплавов системы «железо-углерод»Скачать

где R — газовая постоянная; D Нпл принимается постоянной в интервале Тпл — Т. Строгое применение Шредера уравнения ограничено идеальными растворами. Построив по Шредера уравнению кривые температурной зависимости растворимости для твёрдой фазы каждого из компонентов двойной системы, можно найти эвтектическую точку (см. Эвтектика) и получить растворимости диаграмму.
Шредера уравнение выведено в 1890 И. Ф. Шредером. Оно известно также под названием «логарифмики Шредера» и уравнения Шредера — Ле Шателье (А. Ле Шателье ранее получил зависимость растворимости от температуры в дифференциальной форме, на основании которой в 1894 вывел уравнение, аналогичное Шредера уравнению).
Лит.: Кипнис А. Я., Развитие химической термодинамики в России, М.—Л., 1964. См. также лит. при ст. Растворы.
📺 Видео
09 Фазовые диаграммы 2 правило фазСкачать

ДИАГРАММА СОСТОЯНИЯ ЖЕЛЕЗО-ЦЕМЕНТИТ, железо-углерод, Fe+Fe3CСкачать
Фазовые равновесия | ФизхимияСкачать
Коробов М. В. - Физическая химия. Часть 1 - Двухкомпонентные системы. Правило КоноваловаСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Фазовые диаграммыСкачать

Уравнение ШрёдингераСкачать

Лекция №4 "Волновая функция. Уравнение Шредингера" (Гавриков А.В.)Скачать

08. Арискин А.А. Расчет фазовых диаграмм кристаллизации магм. Программа КОМАГМАТ.Скачать

Бычков А.Ю. - Физическая геохимия - 8. Диаграммы плавкостиСкачать

Гудилин Е. А. - Неорганическая химия I - Фазовые равновесия, диаграммыСкачать

Успенская И. А. - Химическая термодинамика и кинетика - Фазовые диаграммыСкачать

Диаграммы кипенияСкачать

определение реакций в стержнях от действия грузовСкачать