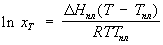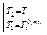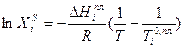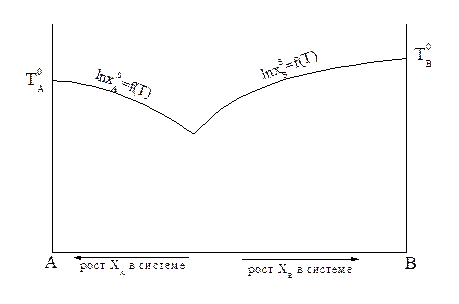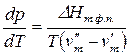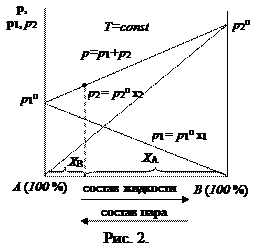Шредера уравнение
Шр е дера уравн е ние, математическое соотношение, выражающее связь между растворимостью кристаллического тела xt при температуре Т (в К), его теплотой плавления D Нпл (в кал/моль) и температурой плавления Тпл:
где R — газовая постоянная; D Нпл принимается постоянной в интервале Тпл — Т. Строгое применение Шредера уравнения ограничено идеальными растворами. Построив по Шредера уравнению кривые температурной зависимости растворимости для твёрдой фазы каждого из компонентов двойной системы, можно найти эвтектическую точку (см. Эвтектика) и получить растворимости диаграмму.
Шредера уравнение выведено в 1890 И. Ф. Шредером. Оно известно также под названием «логарифмики Шредера» и уравнения Шредера — Ле Шателье (А. Ле Шателье ранее получил зависимость растворимости от температуры в дифференциальной форме, на основании которой в 1894 вывел уравнение, аналогичное Шредера уравнению).
Лит.: Кипнис А. Я., Развитие химической термодинамики в России, М.—Л., 1964. См. также лит. при ст. Растворы.
Видео:Урок 455. Уравнение ШрёдингераСкачать

Равновесие раствор – кристаллический компонент
Если два компонента А и В смешать, расплавить до получения однородного раствора, а затем начать охлаждать, то при некоторой температуре из раствора начнут образовываться кристаллы, так как растворимость веществ с понижением температуры, как правило, уменьшается. В зависимости от состава исходного раствора при понижении температуры он становится насыщенным по отношению либо к компоненту А, либо В, что приводит к кристаллизации соответственно А или В. В зависимости от состава раствора температура начала кристаллизации будет также различной. Иначе говоря, состав раствора, насыщенного каким-либо компонентом, т.е. растворимость этого компонента, зависит от температуры.
Уравнением, описывающим зависимость растворимости кристаллических веществ в жидкостях от температуры, является уравнение Шредера:
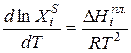
где 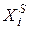
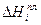
Уравнение Шредера справедливо только для идеальных растворов. Из анализа уравнения (2.7) следует, что растворимость твердых веществ в жидкостях растет с ростом температуры. Действительно, правая часть уравнения для идеальных растворов всегда больше нуля, следовательно, производная 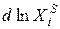
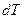
Интегрируя уравнение (2.7) для бинарной системы в пределах от Х1=1 (чистый компонент) до Х2 = X s (насыщенный раствор при любой температуре), получим уравнение Шредера в интегральной форме:
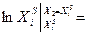
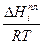
Пользуясь этим уравнением, можно найти растворимость i-гo компонента, выраженную в молярных долях Xi при любой температуре. Если раствор идеален и рассматривается во всём интервале концентраций от ХА = 1 до Хв = I, необходимо иметь в виду, что при одних составах раствор оказывается насыщенным компонентом А (здесь надо говорить о растворимости компонента А в В), при других — компонентом В (здесь уже идет речь о растворимости В в А). В первом случае применимо уравнение Шредера для компонента А; во втором – для компонента В:
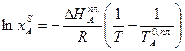
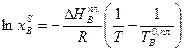
Очевидно, должен быть и такой раствор, который является насыщенным сразу обоими веществами, для него 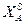
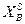
Рисунок 2.4 — Кривые зависимости растворимости компонентов А и В от температуры
Кривые охлаждения
Расчёт диаграмм растворимости (с равным правом их можно назвать диаграммами плавкости) возможен лишь для идеальных систем. Для реальных систем приходится экспериментально определять температуру, при которой раствор данной концентрации становится насыщенным. Это производится путем снятия так называемых кривых охлаждения для систем нескольких составов (метод называется термическим анализом), в координатах (температура; время).
При охлаждении однокомпонентной жидкости сначала происходит равномерное понижение температуры во времени. Появление кристаллов сопровождается выделением тепла, которое компенсирует теплоотвод, и дальнейшего понижения температуры в системе не происходит до полной кристаллизации жидкости, после чего температура снова понижается (рисунок 2.5 а).
Для двухкомпонентной системы наблюдается иной тип кривой охлаждения (рисунок 2.5 б). Сначала жидкая система охлаждается равномерно с определенной скоростью 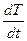
По мере выделения одного из компонентов в третью фазу, происходит накапливание второго компонента в растворе. Наконец при некоторой температуре раствор становится насыщенным по отношению и ко второму компоненту, т.е. начинается кристаллизация обоих компонентов одновременно.
Смесь кристаллов, образующихся при совместной кристаллизации двух компонентов, называется эвтектикой.
Эвтектика имеет определенный состав, наименьшую и всегда постоянную (эвтектическую) температуру кристаллизации (плавления) при данном давлении. Если взять расплав, соответствующий составу эвтектики, то кривая охлаждения будет иметь вид (рисунок 2.5 в). В сплавах, отличающихся по составу от эвтектического, всегда первым будет кристаллизоваться компонент, находящийся в избытке по сравнению с составом эвтектики, а затем, когда избыток выкристаллизуется, а состав станет равным эвтектическому, будет кристаллизоваться эвтектика. Таким образом, у сплавов с различным составом начинается кристаллизация при различных температурах, а заканчивается при одной и той же, эвтектической температуре. Анализируя кривые охлаждения, находят температуры начала кристаллизации расплавов и, нанеся эти точки на диаграмму Т – состав получают линию ликвидуса, а соединяя точки, отвечающие температуре конца затвердевания, вычерчивают линию солидуса. Так получают диаграмму плавкости.
Рисунок 2.5 – Типы кривых охлаждения:
а – для чистого вещества А;
б – для смеси веществ А + В;
в – для эвтектической смеси;
г – кривая охлаждения в случае оразования метастабильного состояния (переохлажденного состояния);
д – для системы, где нет фазовых превращений
Видео:Коробов М. В. - Физическая химия. Часть 1 - Энергия Гиббса образования раствора. Уравнение ШредераСкачать

ВЛИЯНИЕ ДАВЛЕНИЯ НА КОНСТАНТУ ХИМИЧЕСКОГО
РАВНОВЕСИЯ (УРАВНЕНИЕ ПЛАНКА)
Для установления влияние давления на реакции, протекающие с участием газообразных веществ, воспользуемся константой равновесия, выраженной через равновесные мольные доли, Kх= f(T, p).
Выражение (9), записанное в виде 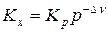
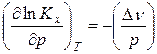
Считая газы, участвующие в реакции, идеальными, можно из уравнения Менделеева-Клапейрона выразить изменение числа моль газообразных веществ в реакции 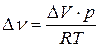
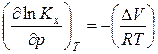
Уравнения (18) и (19) описывают влияние давления на химическое равновесие в идеальной газовой реакции и называют уравнением Планка. Проведем анализ данного уравнения:
1) если реакция протекает с увеличением объема (количества вещества), то при повышении давления 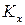
А + B = 3C с ростом давления равновесие смещается в сторону исходных веществ;
2) если реакция протекает с уменьшением объема (количества вещества), то при повышении давления 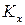
3) если реакция протекает без изменения объема (количества вещества), то при повышении давления 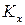
А + B = 2C с ростом давления равновесие не изменяется.
Влияние давления на химическое равновесие в растворе незначительно, так как объем раствора практически не изменяется.
3. растворы и гетерогенные равновесия
3.1. Основные понятия и определения
Термодинамическую систему однородную по физическому строению и химическим свойствам во всех точках, называют гомогенной.
Термодинамическую систему, состоящую из различных по физическим или химическим свойствам частей, отделенных друг от друга поверхностями раздела, называют гетерогенной.
Любая гетерогенная система состоит из нескольких фаз. Фаза – это гомогенная часть гетерогенной системы, ограниченная поверхностью раздела, при переходе через которую свойства системы меняются скачкообразно. Системы делятся на одно–, двух–, трехфазные и т.д.
Каждая система состоит из одного или нескольких веществ, называемых компонентами. Вещества, образующие термодинамическую систему, могут находиться в различных агрегатных состояниях: газообразном, жидком, твердом. Числом независимых компонентов называют наименьшее число индивидуальных компонентов, необходимое для образования данной системы, которое равно общему числу индивидуальных веществ, входящих в данную систему, за вычетом числа уравнений, связывающих равновесные концентрации этих веществ. По числу компонентов различают одно–, двух–, трех– и т.д. компонентные системы.
Любая система характеризуется внешними ( 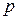
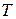
Число концентрационных параметров данной фазы равно числу независимых компонентов, входящих в ее состав фазы, за вычетом единицы (так как, например, если система состоит их двух компонентов, то концентрацию второго компонента можно определить, зная концентрацию первого).
Число независимых термодинамических параметров состояния данной системы, произвольное изменение которых в определенных пределах не вызывает исчезновения одних и образование других фаз называют числом термодинамических степеней свободы или вариантностью системы. По числу термодинамических степеней свободы системы разделяются на инвариантные ( 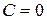
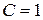
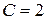
3.2. Термодинамика растворов
3.2.1. ОСНОВНЫЕ ПОНЯТИЯ
Раствором называют гомогенную однофазную систему, состоящую минимум из двух независимых компонентов, в каждом элементарном объеме которого одинаковые физические, химические и термодинамические свойства. В жидких растворах обычно различают растворитель – это вещество, которое имеется в растворе в избытке, и растворенные вещества, хотя все компоненты раствора термодинамически равноценны. Компоненты, находящиеся в растворе в меньшем количестве называют растворенными веществами.
Растворы подразделяют на идеальные и реальные. Идеальным называют раствор, все компоненты которого характеризуются одинаковой формой и размером молекул и одинаковой энергией межмолекулярных взаимодействий. Идеальные растворы встречаются довольно редко. Это гомогенные смеси близких по физико-химическим свойствам веществ (смеси оптических изомеров, соседних членов одного и того же гомологического ряда). Моделью идеального газового раствора является смесь идеальных газов.
Большинство растворов являются реальными, их компоненты отличаются либо по форме, либо по размерам, либо по энергии межмолекулярных взаимодействий.
Все свойства растворов подразделяют на экстенсивные и интенсивные.
Экстенсивные свойства, зависят как от общей массы раствора, так и от его состава, например 
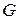
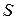
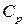
Интенсивные свойства, зависят только от состава раствора и не зависят от его общей массы, например, давление насыщенного пара.
Для характеристики растворов используют средние мольные и парциальные мольные свойства.
Среднее мольное свойство – экстенсивное свойство 1 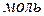
Парциальное мольное свойство 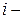
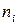
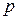
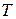
Среди парциальных молярных величин наибольшее значение имеет парциальная мольная энергия Гиббса, которая называется химическим потенциалом 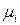
Химический потенциал является интенсивным свойством раствора.
3.2.2. УСЛОВИЕ РАВНОВЕСИЯ В ГОМОГЕННЫХ РАСТВОРАХ
Равновесие в гомогенном идеальном растворе выражает уравнение Гиббса–Дюгема:

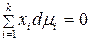
которое для двухкомпонентного раствора записывается в виде
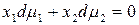
Равновесие в гомогенном реальном растворе выражает уравнение Дюгема–Маргулеса:

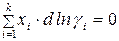
Для двухкомпонентного раствора условие равновесия записывается:
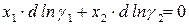
3.3. гетерогенные равновесия
3.3.1. равновесие в гетерогенной системе. Правило фаз гиббса
Условием термодинамического равновесия в гетерогенной системе является равенство химических потенциалов каждого компонента во всех фазах при 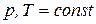
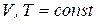

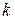
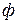
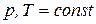
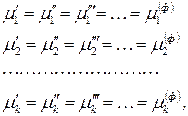
где индекс 1, 2,…, 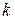
¢,²,¢¢¢,…, 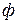

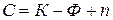
где 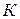
n – число внешних параметров, влияющих на состояние равновесия.
Если на систему влияют два внешних параметра ( 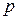
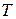
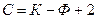
Применим правило фаз Гиббса к анализу диаграммы состояния однокомпонентной системы, например, воды. В области средних давлений и средних температур вода может находиться в жидком, твердом (лед) и газообразном (пар) состояниях.

плоскость ОВС отвечает состоянию воды;
АОС – состоянию пара;
АОВ – состоянию льда;
О – тройная точка;
ОВ – кривая плавления;
ОС – кривая испарения;
ОА – кривая возгонки;
ОD – кривая давления насыщенного пара над переохлажденной водой.
Определим число степеней свободы в точках 1, 2 и тройной точке О.
В точке 1 вода находится в жидком состоянии, следовательно, число фаз 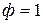
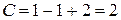
Число степеней свободы равно двум или система дивариантна. Это означает, что можно произвольно в определенных пределах изменять два параметра: давление и температуру, при этом число и вид фаз системы не изменится.
Точка 2 находится на кривой испарения, следовательно, в равновесии находятся две фазы: жидкость и пар. Тогда
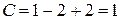
Система моновариантна, следовательно, возможно изменение одного параметра: температуры или давления, при котором число и вид фаз системы не изменится.
В тройной точке О в равновесии находятся три фазы: вода, лед и пар, тогда
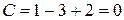
Система нонвариантна. Это означает, что три фазы могут находиться в равновесии только при определенных условиях.
3.3.2. Уравнение состояния однокомпонентной двухфазной системы
Состояние однокомпонентной двухфазной системы характеризуется уравнением Клаузиуса–Клапейрона:
где 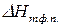
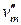
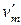
Для процесса возгонки и испарения можно допустить, что 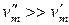
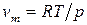

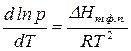
Разделив переменные и проинтегрировав в определенных пределах в узком интервале температур, считая 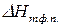
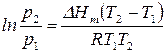
На основе полученного уравнения можно рассчитать:
1) температуру кипения вещества 
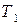
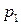
2) давление насыщенного пара индивидуального вещества 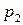
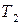
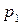
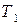
3) среднюю мольную теплоту испарения или возгонки вещества, если известны значения давления насыщенного пара вещества при двух температурах.
3.3.3. фазовое равновесие жидкость-пар
Пусть существуют в состоянии равновесия жидкость и выделяющийся из нее пар. Если жидкий раствор является идеальным, то во всем интервале концентраций растворитель и растворенное вещество подчиняются закону Рауля:

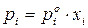
где 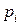
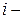
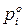
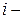
Для двухкомпонентного раствора можно записать:
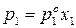
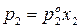
Так как 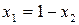
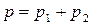
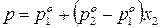
Таким образом, зависимость давления насыщенного пара компонентов и общего давления пара от состава идеального раствора является линейной (диаграмма 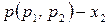
На практике чаще приходится встречаться с неидеальными растворами, которые не подчиняются закону Рауля. Для описания зависимости давления насыщенного пара компонента от состава реального раствора в закон Рауля вводится коэффициент активности:
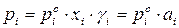
Для двухкомпонентного раствора общее давление смеси равно:
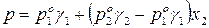
Поскольку коэффициенты активности 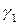
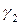
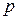
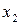
зависят от относительной величины энергии взаимодействия молекул жидкой смеси.

Точки на диаграммах 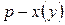
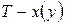
Как видно из рис. 4, в точке азеотропа состав жидкой и паровой фаз одинаков. Бинарные смеси, которые содержат азеотроп, называют азеотропными.
Состав равновесного с жидким раствором пара определяется согласно закону Дальтона:

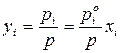

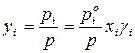
Из анализа последних уравнений видно, что рассчитать равновесный состав пара можно только для идеального раствора заданного состава. Для расчета равновесного состава паровой фазы реального раствора необходимо знать коэффициенты активности, численные значения которых определяют только экспериментальным путем.
Для представления данных по фазовому равновесию жидкость-пар кроме рассмотренных диаграмм применяют также диаграммы 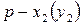
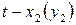
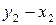
Для разделения жидких бинарных смесей используют методы перегонки и ректификации (многократной перегонки), которые основаны на различие составов жидкой и паровой фаз. Азеотропные смеси этими методами разделить невозможно. Для разделения азеотропных смесей необходимо создать условия, устраняющие азеотроп. Например, изменить значения внешних параметров ( 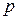
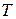
Эбуллиоскопия
Эбуллиоскопия – явление повышения температуры кипения раствора нелетучего вещества по сравнению с температурой кипения чистого растворителя.
Основной закон эбуллиоскопии записывается:

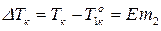
где 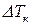
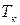
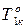
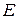
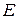

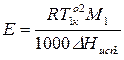
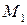
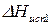
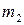
3.3.4. Фазовое равновесие твердое тело-жидкость. Уравнение шредера
Предположим, что в состоянии термодинамического равновесия существуют раствор твердого вещества в жидком растворителе и кристаллы данного твердого вещества. Равновесие в такой системе описывается уравнением Шредера:
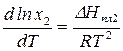
где 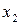
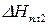
После интегрирования получаем:
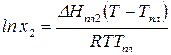
где 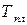
Полученное уравнение справедливо для растворов, близких по свойствам к идеальным, поэтому уравнение Шредера позволяет рассчитывать растворимость только малорастворимых веществ.
Криоскопия
Криоскопия – явление понижения температуры замерзания раствора нелетучего вещества по сравнению с температурой замерзания чистого растворителя.
Основной закон криоскопии записывается:

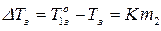
где 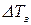
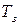
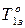
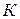
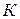

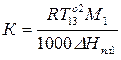
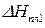
Методы криоскопии и эбуллиоскопии часто применяют для расчета молекулярной массы растворенного вещества.
3.3.5. фазовое равновесие жидкость-жидкость
Пусть в сосуде находятся две жидкости, практически не смешивающиеся друг с другом, например, вода и хлороформ. Если ввести в эту систему небольшое количество третьего вещества, например йода, то оно вполне определенным образом распределится между двумя жидкими фазами. В соответствии с законом распределения Нернста: при установлении равновесия отношение концентраций распределяющегося вещества в двух несмешивающихся жидкостях есть величина постоянная при постоянной температуре:

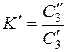
где 
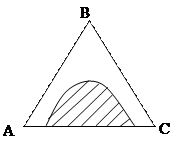
Состояние трехкомпонентных систем с ограниченной растворимостью принято изображать с помощью треугольных диаграмм. На рисунке приведена диаграмма растворимости в трехкомпонентной системе с одной парой ограниченно смешивающихся компонентов 
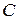
4. химическая кинетика
Химическая кинетика – наука о скорости протекания химической реакции.
Скорость химической реакции – изменение концентрации одного из реагирующих веществ в единицу времени.
Поскольку в реакциях вещества участвуют в стехиометрических соотношениях, за скорость реакции может быть принята производная от концентрации любого из реагирующих веществ по времени:

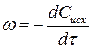
где 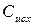
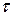
Концентрация исходных веществ убывает, поэтому перед производной стоит знак минус.


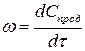
Скорость реакции в момент времени 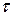
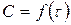
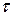
4.1. основной закон химической кинетики.
🎬 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

8 класс. Составление уравнений химических реакций.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Способы выражения концентрации растворов. 8 класс.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Задача на приготовление растворов методом "КРЕСТА". Включает См и массовую долю р-ров.Скачать

Тренировки раньше и сейчас #batya #батя #тренировки #орехов #виталяорехов #раньшебылолучшеСкачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовая диаграмма воды. Закон Рауля. Закон ГенриСкачать

Задача на разбавление уксусного ангидрида уксусной кислотой. Органика. Олимпиада.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать