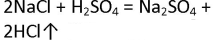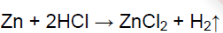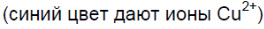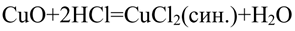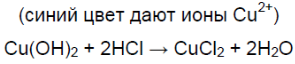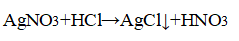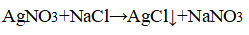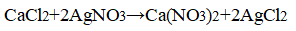- NaCl + H2SO4 HCl + NaHSO4
- Вопросы к параграфу 16 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 16. Практическая работа №3.
- Получение соляной кислоты и изучение её свойств
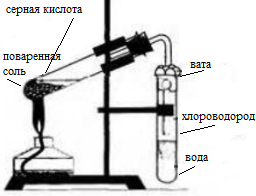
- 1. Получение соляной кислоты. Соберите прибор, как показано на рисунке 13 (см. с. 56). В пробирку насыпьте 2—3 г поваренной соли и прилейте концентрированную серную кислоту (2 : 1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5—1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5—6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой! Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании. Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз? Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
- 2. Химические свойства соляной кислоты. Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II) в шестую — немного мела или другого карбоната. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами. Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? составьте уравнения соответствующих реакций.
- 3. Распознавание соляной кислоты и её солей. В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция.во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте. Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты. Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)? Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
- При взаимодействии избытка концентрированной серной кислоты и 117 г хлорида натрия получили хлороводород, который затем был
- Ваш ответ
- решение вопроса
- Похожие вопросы
- 🎬 Видео
Видео:хлорид натрия и серная кислотаСкачать

NaCl + H2SO4  HCl + NaHSO4
HCl + NaHSO4
Реакция взаимодействия хлорида натрия и серной кислоты с образованием хлороводорода и гидросульфата натрия. Хлорид натрия твердый. Серная кислота — концентрированный раствор. Реакцию проводят при температуре 30-50°C [8] (около 150°C [17] ).
Промышленный метод получения хлороводорода. [12,17] Используется в тех случаях, когда минеральное сырье (каменная соль) доступно по цене. [17]
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Вопросы к параграфу 16 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

§ 16. Практическая работа №3.
Получение соляной кислоты и изучение её свойств
1. Получение соляной кислоты. Соберите прибор, как показано на рисунке 13 (см. с. 56). В пробирку насыпьте 2—3 г поваренной соли и прилейте концентрированную серную кислоту (2 : 1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5—1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5—6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой! Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании. Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз? Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Получение соляной кислоты
Насыпали 2-3 г. поваренной соли и прилили концентрированную кислоту (2:1). Закрыли пробирку пробкой с газоотводной трубкой, конец трубки опустили в пробирку с водой, чтобы он находился над уровнем воды на 1 см. нагрели смесь с помощью спиртовки.
Появление в пробирке с водой тонких струек объясняются выделяющимся хлороводородом. Конец газоотводной трубки надо выставить на расстоянии 0,5 см, чтобы воду не засосало в пробирку с серной кислотой, иначе произойдёт взрыв и пробирка лопнет.
В лаборатории соляную кислоту можно получить с помощью растворения в воде хлороводорода, который получают воздействием концентрированной H2SO4 на хлорид.
2. Химические свойства соляной кислоты. Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II) в шестую — немного мела или другого карбоната. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами. Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? составьте уравнения соответствующих реакций.
Химические свойства соляной кислоты
Лакмусовая бумажка окрашивается в красный цвет.
Есть кислотные свойства.
Выделяется бесцветный газ
Zn или Mg стоят левее водорода в ряду напряжений, поэтому реагируют с соляной кислотой с выделением водорода.
Изменений не происходит
Медь стоит правее водорода в ряду напряжений, поэтому реакция не идёт.
Чёрный порошок растворяется, образуется раствор синего цвета.
Реагирует с основными оксидами.
Синий осадок растворяется, образуется раствор синего цвета.
Реагирует с нерастворимыми основаниями.
Выделяется бесцветный газ.
Реагирует с солями слабых кислот
3. Распознавание соляной кислоты и её солей. В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция.во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте. Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты. Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)? Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
Распознавание соляной кислоты её солей
Прилили раствор нитрата серебра
Взаимодействие с нитратом серебра является качественной реакцией на хлорид-ионы.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Выпадение белого осадка, нерастворимого в азотной кислоте.
Отличить а) и б) можно, применяя раствор нитрата серебра (I), потому что образовывается нерастворимый в концентрированной азотной кислоте белый осадок — хлорид серебра (I).
в) применить индикатор и щёлочь, при этом изменится цвет индикатора из кислотной среды в нейтральную в случае соляной кислоты.
Заменить раствор серебра (I) нитратом свинца можно, потому что идёт такая же качественная реакция с образованием белого осадка, но он растворяется в азотной кислоте.
Видео:Реакция Хлорида Натрия, Оксида Марганца и Серной Кислоты. Реакция NaCl,MnO2 и H2SO4. Выделение ХлораСкачать

При взаимодействии избытка концентрированной серной кислоты и 117 г хлорида натрия получили хлороводород, который затем был
Видео:Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Ваш ответ
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

решение вопроса
Видео:Распознавание растворов хлорида бария, сульфата натрия и серной кислотыСкачать

Похожие вопросы
- Все категории
- экономические 43,415
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,066
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
🎬 Видео
Серная и азотная кислоты! | Химия ЕГЭ 10 класс | УмскулСкачать

Серная кислота и ее соли. 9 класс.Скачать

Реакция Концентрированной Серной Кислоты и Хлората Натрия. Реакция H2SO4 и NaClO3. Выделение ClO2.Скачать

Взаимодействие цинка с серной кислотойСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Серная кислота. Химические свойства. Реакции с металлами.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

78. Получение хлороводорода взаимодействием серной кислоты с хлоридом натрияСкачать

Взаимодействие гидроксида натрия с серной и кремниевой кислотойСкачать

Реакция СУЛЬФИТА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Простые опыты по химии.Скачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Разбор демоверсии 2023 | Химия ЕГЭ 2023 | УмскулСкачать

Неметаллы. Тема 15. Серная кислота. Соли серной кислотыСкачать

 HCl + NaHSO4
HCl + NaHSO4