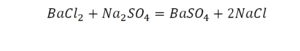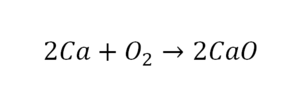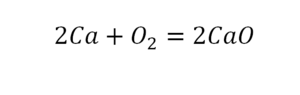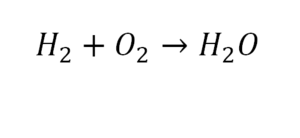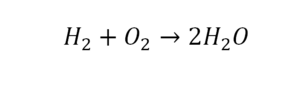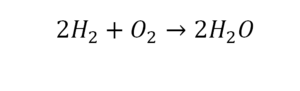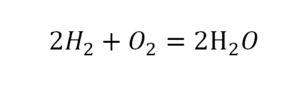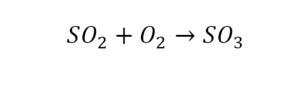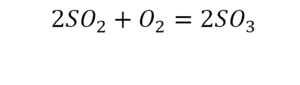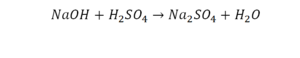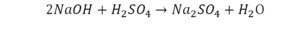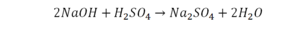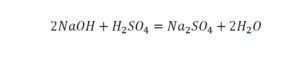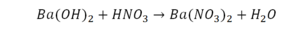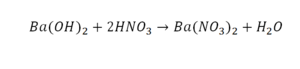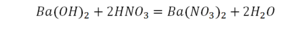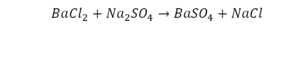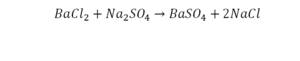По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Видео:Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Уравнение с самыми большими коэффициентами химия
Эта цитата не из учебника арифметики для 1-го класса. Она взята из книги немецкого химика Иеремии Вениамина Рихтера (17621807) Начальные основания стехиометрии или искусство измерения химических элементов , опубликованной в 1793 и предназначенной для вполне взрослых химиков. Сейчас кажется удивительным, что когда-то были химики, не знающие твердо правил сложения и вычитания. Конечно, это относилось далеко не ко всем химикам. Выдающиеся представители этой науки могли бы подписаться под словами немецкого философа Иммануила Канта , который в одной из своих публичных лекций сказал, что в отдельных ветвях естественных наук истинной науки столько, сколько в ней математики. Лекции Канта произвели глубокое впечатление и на Рихтера.
Слово «стехиометрия» в названии книги изобретение автора. Рихтер произвел его от греческих слов stoicheion основание, элемент и metreo измеряю, что должно было означать измерение соотношений, в которых химические элементы реагируют друг с другом. То, что сейчас кажется само собой разумеющимся, например, расчеты по химическим уравнениям, было совершенно непривычно для химиков того времени. В своей книге Рихтер писал: «. если для растворения 2 частей извести требуется 5 частей соляной кислоты, то для растворения 6 частей извести потребуется 15 частей соляной кислоты». У Рихтера мы находим и первые в истории химии количественные уравнения реакций. Например, по его данным, из 2400 гранов карбоната кальция при сильном прокаливании получается 1342 грана CaO, т.е. реакция разложения CaCO 3 ® CaO + CO2 характеризуется соотношением CaCO 3 : CaO = 1,788: 1. Это удивительно хорошо согласуется с современным расчетом, который дает соотношение 1,786:1 (гран старинная единица массы. Название происходит от латинского granum зернышко, крупинка: когда-то гран соответствовал массе одного пшеничного зерна. В Германии во времена Рихтера 1 гран
После того, как стали общепризнанными атомно-молекулярное учение, законы сохранения массы, постоянства состава, кратных отношений, закон Авогадро , химики получили теоретическое обоснование законов стехиометрии Рихтера.
Понятие стехиометрии чаще всего относят к химическим реакциям. Если исходные вещества вступают в химическое взаимодействие в строго определенных соотношениях, а в результате реакции образуются продукты, количество которых поддается точному расчету, то такие реакции называются стехиометрическими. Зная относительные молекулярные массы различных соединений, можно рассчитать, в каких соотношениях эти соединения будут реагировать. Мольные соотношения между веществами участниками реакции показывают коэффициенты, которые называются стехиометрическими.
Стехиометрическими должны быть все реакции, которые используются в количественном анализе. Ведь химик-аналитик должен быть уверен, что с данным количеством какого-либо вещества, которое вступает в реакцию, прореагирует совершенно определенное количество другого реагента и образуется определенное количество продуктов реакции. Например, при осаждении ионов бария в соответствии с уравнением Ba 2+ + SO4 2 ® BaSO4 1 г находящегося в растворе бария дает всегда 1,699 г осадка. Примером стехиометрической реакции с участием органического вещества является окисление щавелевой кислоты перманганатом калия в кислой среде. Эта реакция в точности соответствует уравнению 5H2C2O4 + 2KMnO4 + 3H2SO4 ® 2MnSO4 + K2SO4 + 10CO2 + 8H2O. Поэтому ее используют в аналитической химии для точного определения концентрации KMnO 4 в растворе (количество щавелевой кислоты определяют по навеске дигидрата щавелевой кислоты H 2C2O4 . 2H2O).
Далеко не все реакции являются стехиометрическими. Большинство органических реакций и некоторые неорганические не являются стехиометрическими; такие реакции часто идут одновременно в нескольких направлениях. В зависимости от условий проведения реакции будет преобладать то или иное направление, а выход продуктов будет несколько варьироваться от опыта к опыту. Для примера возьмем крекинг октана, т.е. его распад при высоких температурах: C 8H18 ® 2C2H4 + C3H6 + CH4 . Эта сложная цепная реакция никогда не идет точно по написанному уравнению, каждый раз соотношение указанных продуктов будет несколько иным, кроме того, в небольших количествах образуются и побочные вещества. А при крекинге этана помимо основных продуктов, этилена и водорода, образуются также метан, ацетилен, углеводороды, содержащие 3 и более атомов углерода.
А вот примеры из неорганической химии. При нагревании чистая бертолетова соль плавится и затем разлагается. При этом хлорат калия частично разлагается с выделением кислорода по схеме 4KClO 3 ® 4KCl + 6O2 (этому направлению реакции способствуют катализаторы), а частично переходит в перхлорат: 4KClO 3 ® 3KClO4 + KCl. Если эти уравнения сложить, получим нестехиометрическое уравнение 8KClO 3 ® 5KCl + 3KClO4 + 6O2 , которое показывает только, какие вещества могут получиться при разложении KClO 3 , но никак не отражает количественного их соотношения. Расчеты по такому уравнению делать нельзя. Более того, если нагреть смесь очень сильно (выше 600 о С), то и КСlО 4 начинает разлагаться с выделением кислорода. Таких примеров можно привести много. Например, при разложении нитрата аммония выделяется множество продуктов, потому что реакция идет одновременно по нескольким направлениям, так что по уравнению NH 4NO3 ® N2O + 2H2 O нельзя рассчитать, сколько надо взять нитрата аммония, чтобы получить 1 л оксида азота (I).
Еще одна интересная особенность, связанная со стехиометрией и коэффициентами, заключается в следующем. Если в уравнении какой-либо химической реакции коэффициенты «правильно» отражают соотношение атомов элементов в левой и правой частях уравнения, то это еще не означает, что коэффициенты являются стехиометрическими. Для некоторых химических реакций можно записать уравнения, которые на первый взгляд кажутся совершенно правильными: формальный подсчет числа атомов каждого элемента в левой и правой части уравнения показывает, что они равны, но тем не менее уравнение не соответствует действительности. Таких уравнений, в которых формально сохраняется баланс по каждому элементу, можно записать бесчисленное множество, и все они будут совершенно неверными! В качестве примера можно привести уравнения для реакции перманганата калия с пероксидом водорода в кислой среде:
Эта реакция используется в аналитической химии для количественного определения пероксида водорода. Но все расчеты при этом основаны на том, что в действительности на 2 молекулы перманганата всегда расходуется ровно 5 молекул пероксида в соответствии с уравнением
Все же другие уравнения реакции, несмотря на правильный баланс по каждому атому, не имеют химического смысла.
Еще один пример. Если на черный сульфид свинца подействовать озоном, он окислится до белого сульфата свинца. Но если записать уравнение этой реакции в виде PbS + 2O 3 ® PbSO4 + O2 , то оно окажется неверным, несмотря на сохранение баланса по каждому элементу. Причина проста: для окисления одного атома серы S 2 в сульфиде до S +6 в сульфате требуется 4 атома кислорода, которые сами при этом восстанавливаются до O 2 . Однако в условиях проведения реакции одна молекула озона, распадаясь по схеме О 3 > О 2 + О, может дать только один «активный» атом кислорода, который и является окислителем. Поэтому для окисления одного моля PbS необходимо четыре моля O 3 , но никак не два, и правильное уравнение, описывающее эту реакцию, выглядит так: Pb S + 4O3 ® PbSO4 + 4O2.
А вот аналогичный пример из органической химии: «правильно» на первый взгляд сбалансированное уравнение 3(CH 3)3COH + 6O2 ® 2(CH3)2CO + 2CH3COOH + 2CO2 + 5H2 O на самом деле лишено химического смысла. Действительно, при окислении третичного бутилового спирта (эту реакцию проводят обычно с помощью очень сильных окислителей, например дихромата калия или перманганата калия в кислой среде, или с кислородом в присутствии катализаторов) происходит разрыв связи CC с образованием одной молекулы кетона в данном случае ацетона, тогда как отщепившаяся метильная группа CH 3 окисляется до CO 2 и H 2 O. Очевидно, что из трех молекул исходного спирта можно таким образом получить три молекулы ацетона (CH 3)2 CO. Ацетон может окисляться далее; при этом также разрывается связь CC и получается уксусная кислота, диоксид углерода и вода. В соответствии с приведенным выше уравнением осталось 2 молекулы ацетона, значит, до уксусной кислоты окислилась только одна, но как тогда образовались две молекулы кислоты? Вместе с тем в случае образования двух молекул кислоты должна была остаться только одна молекула ацетона, но никак не две. Таким образом, из трех молекул исходного спирта не могли получиться одновременно две молекулы кислоты и две молекулы кетона!
Рассмотренные примеры позволяют сделать два вывода. Во-первых, наличие материального баланса, т.е. правильность записи уравнения реакции с алгебраической точки зрения, еще не означает, что это уравнение верно и с точки зрения химической. Во-вторых, все нестехиометрические реакции оказались сложными, представляющими совокупность ряда последовательных или параллельных стадий. Если же реакция простая и идет в одну стадию, то она обязательно будет стехиометрической.
В учебниках химии можно встретить уравнения с очень большими коэффициентами. Например:
4Zn + 10HNO3 ® 4Zn(NO3)2 + NH4NO3 + 3H2 O (эта реакция идет с сильно разбавленной азотной кислотой, на экзаменах по химии экзаменаторы нередко требуют записать это уравнение и подобрать к нему коэффициенты);
18P + 20CuSO4 + 32H2O ® 8H3PO4 + 5Cu + 5Cu3P2 + 20H2SO4 (эту реакцию используют для нейтрализации белого фосфора) и т.д.
Все подобные реакции, без сомнения, сложные, идут в несколько стадий и не являются стехиометрическими. Так, цинк может восстанавливать азот в разбавленной азотной кислоте не только до степени окисления 3, но и частично до других степеней окисления.
«Рекордсменом» среди уравнений этого типа является реакция, предложенная много лет назад одним из сотрудников американского «Журнала химического образования» (Journal of Chemical Education) Л.С.Фостером. Он предложил Норрису Рэйкстроу, который в то время был главным редактором этого журнала, подобрать коэффициенты в уравнении такой реакции: [Cr(N 2H4CO)6]4[Cr(CN)6] + MnO4 + H + ® Cr2O7 2 + CO2 + NO3 + Mn 2+ + H2 O. В этой реакции перманганат окисляет сложное комплексное соединение, в котором хром образует комплексный катион с мочевиной и комплексный анион с цианидом. В ноябре 1943 это уравнение появилось на страницах журнала с таким сопровождением главного редактора: «Л.С.Фостер уверяет, что коэффициенты подобрать можно, хотя у него самого на это ушло времени на 1 доллар 27 центов, если считать на его современную почасовую оплату. Я хотел бы знать, кто сможет сделать это быстрее. Ждем писем!»
Редакция получила немало писем с решением, причем читателями были использованы все основные методы подбора коэффициентов: метод электронного баланса, метод ионных полуреакций и алгебраический метод. Рекордным было время 15 минут! (Кстати, сейчас простенькая компьютерная программа сделает это за ничтожные доли секунды.)
Итоговое уравнение имеет поистине чудовищные коэффициенты:
Настоящий химический монстр! Нет сомнений, что эта реакция нестехиометрическая и ее коэффициенты лишь приближенно отражают соотношение реагентов и продуктов.
Можно ли заранее узнать, является ли данное уравнение стехиометрическим и, следовательно, возможна ли для него единственно правильная расстановка коэффициентов? Хотя однозначно ответить на этот вопрос можно лишь на основании эксперимента, существует правило, которое позволяет предсказать, возможна ли в принципе для данного уравнения единственная расстановка коэффициентов. Правило это основано на чисто математических закономерностях, которые впервые были рассмотрены ещё в 1878 английским химиком Дж.Боттомли; оно звучит так: «Если число исходных веществ и продуктов реакции равно числу химических элементов, из которых эти вещества состоят, то возможна единственная расстановка коэффициентов». Это следует из того, что при использовании «алгебраического метода» подбора коэффициентов (именно на нем основаны компьютерные программы) число всех участвующих в реакции веществ равно числу коэффициентов, которые надо найти, а число химических элементов равно числу алгебраических уравнений с этими неизвестными. Например, в реакции aNaOH + bH 2SO4 ® cNa2SO4 + dH2 O имеется четыре неизвестных, для которых можно составить четыре уравнения (по числу веществ).
В большинстве окислительно-восстановительных реакций число неизвестных на единицу больше числа возможных уравнений. Казалось бы, в таком случае система уравнений становится неопределенной и имеет бесчисленное множество решений. Но это в математике. В химии же решение продолжает оставаться единственным. Объясняется это тем, что уравнения с кратными коэффициентами химики не считают разными уравнениями: они просто сокращают коэффициенты до минимальных.
Нередко встречаются случаи, когда число неизвестных коэффициентов на два больше числа уравнений. В этих случаях формальных решений становится бесконечно много, и все они разные. Химический же смысл часто имеет только одно, как в уже приводившемся примере реакции KMnO 4 c H2O2 в кислой среде. К этому же типу относится и рассмотренная выше реакция окисления сульфида свинца: aPbS + bO 3 ® cPbSO4 + dO2 . На первый взгляд, число неизвестных коэффициентов (a, b, c, d) только на единицу превышает число уравнений (три элемента Pb, S, O). Однако в данном случае число уравнений уменьшается до двух, потому что свинец и сера и в левой, и в правой части присутствуют в одинаковых соотношениях. Следовательно, алгебраические уравнения, составленные для каждого из этих элементов, будут идентичны, и одно из них попросту окажется «лишним». Так что алгебраических уравнений здесь не три, а только два, тогда как неизвестных четыре.
Понятие стехиометрии относят не только к химическим уравнениям, но и к химическим соединениям. Стехиометрическими называются соединения, в которых химические элементы присутствуют в строго определенных соотношениях. Примером стехиометрических соединений могут служить вода Н 2 О, сахароза С 12 Н 22 О 11 и практически все другие органические, а также множество неорганических соединений. В то же время многие неорганические соединения в силу разных причин могут иметь переменный состав и потому не являются стехиометрическими. Так, оксид титана(II) имеет переменный состав, в котором на один атом титана может приходиться от 0,65 до 1,25 атомов кислорода. Натриевольфрамовая бронза (вольфрамат натрия) по мере удаления из нее натрия меняет свой цвет от золотисто-желтого (NaWO 3 ) до темного сине-зеленого (Na 0,3WO3 ), проходя через промежуточные красный и фиолетовый цвета. И даже хлорид натрия может иметь нестехиометрический состав, приобретая желтый цвет при избытке металла. Такие нестехиометрические соединения называют бертоллидами по имени французского химика Клод Луи Бертолле , который полагал, что химические соединения могут иметь переменный состав.
Леенсон И.А.. Занимательная химия. М., Дрофа, 1996, ч. 1
Леенсон И.А. Занимательная химия. М., Росмэн, 2000
📹 Видео
8 класс. Составление уравнений химических реакций.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

КОЭФФИЦИЕНТЫ в уравнении реакции. #школа #химия #химияогэ #химияегэ #химияпростоСкачать

Химические уравнения 8 класс - как расставить коэффициенты ?Скачать

СтехиометрияСкачать

Коэффициенты в уравнениях химических реакцийСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как уравнивать коэффициенты (химия)Скачать