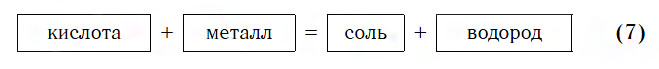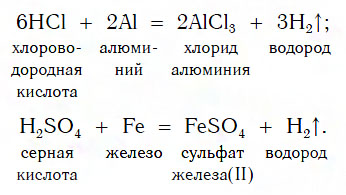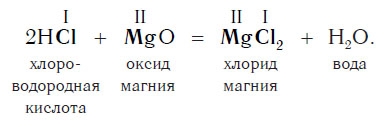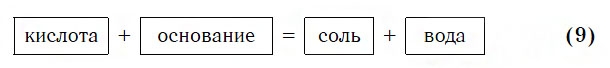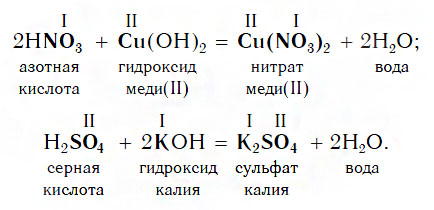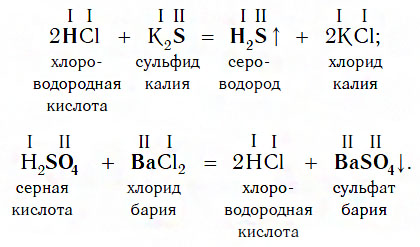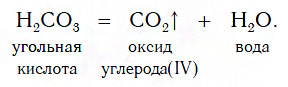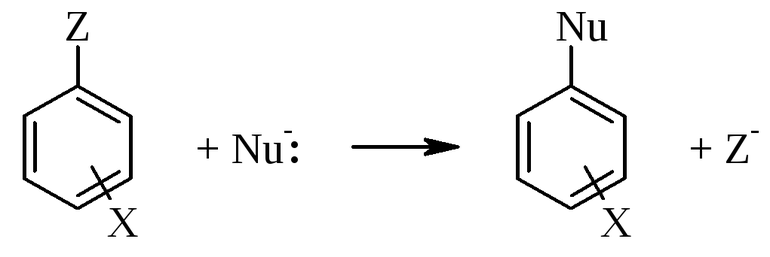В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.
В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот. Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами. Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
- Изменение окраски индикаторов
- Взаимодействие с металлами
- Реакции с основными оксидами
- Взаимодействие с основаниями
- Взаимодействие с солями
- Разложение кислот на кислотные оксиды и воду
- Урок по химии на тему: «Типы химических реакций. Реакции замещения». 8-й класс
- Ход урока:
- I. Opr момент. Вступление. Оценка эмоционального состояния.
- II. Повторение изученного, актуализация знаний.
- III. Изучение новой темы.
- IV.Оценка эмоционального состояния.
- Реакция замещения в химии — как определить, признаки, примеры уравнений
- Общие сведения
- Механизмы взаимодействия
- Электрофильные и нуклеофильные
- Радикальные реакции
- Типичное замещение
- Примеры и онлайн-решения
- 🔍 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Видео:Реакции замещенияСкачать

Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в
водных растворах не реагируют.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
Пример уравнения реакции, протекающей в соответствии с этой схемой:
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды. А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
- Кислоты в растворах изменяют окраску индикаторов.
- Кислоты реагируют с металлами, основными оксидами, основаниями и солями.
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Урок по химии на тему: «Типы химических реакций. Реакции замещения». 8-й класс
Разделы: Химия
Класс: 8
Тема: Реакции замещения.
Цель: дать понятие о сущности реакций замещения.
– продолжить формирование умения записывать уравнения химических реакций;
– экспериментально установить какие реакции являются реакциями замещения;
– начать формирование умения предсказывать продукты реакций замещения;
– дать первоначальное понятие об электрохимическом ряде напряжений металлов.
– развивать когнитивную сферу учащихся;
– развивать общеучебные умения и навыки: работа по плану; работа с учебником;
– сформировать умение пользоваться лабораторным оборудованием и реактивами;
– развивать мыслительные операции учащихся: сравнение, анализ, синтез;
– развивать умение анализировать результаты опыта;
– развивать умение делать самостоятельные выводы;
– развивать внимание учащихся и его свойства: объём внимания, концентрация внимания, распределение внимания; развивать разные виды памяти учащихся: механическую, слуховую и пр.
– прививать культуру умственного труда и сотрудничества;
– воспитывать дисциплинированность учащихся;
– воспитывать чувство ответственности;
– способствовать созданию благоприятного психо-эмоционального климата на уроке.
Тип урока: урок усвоения новых знаний.
– словесные (рассказ, объяснение, беседа);
– иллюстративные (схемы химических реакций);
– частично-поисковый, проблемный (проблемная ситуация).
ФОПД: фронтальная, индивидуально – обособленная, групповая (динамические группы).
Технологии: элементы технологии “Сотрудничества” и “Проблемного обучения”.
Оборудование и реактивы:
– Zn, Mg, Al, Си, Li, Na, Ca – металлы;
1) Взаимодействие щелочных Me с Н2О;
Ход урока:
I. Opr момент. Вступление. Оценка эмоционального состояния.
II. Повторение изученного, актуализация знаний.
Крестики – нолики: (на доске)
| H2SO4 | Li ОН | Zn CI2 |
| Al2 (SO4)3 | НС1 | Na OH |
| AlCl3 | Са (ОН)2 | HNO3 |
| НCl | Li ОН | Cu (NO3)2 |
| NaOH | H2SO4 | A12(SO4)3 |
| HNO3 | Са (ОН)2 | ZnCl2 |
| НС1 | А1С13 | FeSO4 |
| Са (ОН)2 | Li ОН | NaOH |
| Н2О | ZnCl2 | Cu (NO3)2 |
Работа в парах (взаимопроверка): 2 мин.
Составьте формулы (на листочках через копирку):
| I ряд | II ряд | III ряд |
| Хлорид Zn | Гидроксид Li | Сульфат Fe (II) |
| Сульфат Al | Гидроксид Na | Нитрат Cu (II) |
| Хлорид Al | Гидроксид Ca |
Один листочек сдайте мне, другой отдайте соседу, для проверки – 1 мин.
III. Изучение новой темы.
I. Понятие о реакциях замещения на примере взаимодействия кислот с металлами.
Учитель начинает объяснение с того, что рассказывает об открытии водорода Генри Кавендишем (1766 год) и предлагает посмотреть опыт. В раствор опускается гранула (нужно сразу же объяснить это новое понятие – “зёрнышко”, “кусочек”) цинка – начинается выделение пузырьков газа, который учитель собирает в перевёрнутую пробирку большего диаметра.
Объясняется, что этот способ называется способом вытеснения воздуха, а пробирка перевёрнута потому, что водород легче воздуха.
Затем учитель показывает способ распознавания водорода в двух модификациях:
1) если он собирал Н2 в перевёрнутую пробирку, то при поднесении к ней горящей спички слышен характерный “лающий” взрыв – значит, собран водород в смеси с воздухом – не чистый газ;
2) если же спичка подносится к самой пробирке, где идёт реакция, которую учитель предварительно прикрыл большим пальцем, то слышится “глухой” хлопок – взрыв, значит, собран чистый водород, без примеси воздуха.
Учитель предлагает записать уравнение проделанной реакции: (совместно с ребятами)
Следовательно, из исходных простого и сложного веществ образовалось новое простое и новое сложное. Такие реакции называются реакциями замещения.
Учитель предлагает ребятам записать аналогичную реакцию для серной кислоты и магния:
И усложняет для серной кислоты и алюминия:
Вначале выводится формула соли Al2 (SO4)3
А затем уравнивается запись – учитель рекомендует при уравнивании реакций с участием солей начинать именно с их формул ( “два алюминия и три остатка”):
и, наконец, водород:
II. Электрохимический ряд напряжений металлов и два его правила.
Учитель ставит проблемный вопрос: “А любой ли металл способен вступить в реакцию замещения с кислотой?” – и демонстрирует отсутствие взаимодействия между НСl и Сu. Оказывается, для решения этого вопроса можно воспользоваться ещё одной узаконенной “шпаргалкой” – электрохимическим рядом напряжений металлов (можно на этом этапе давать другое определение – ряд активности – просто и понятно): если металл стоит в этом ряду до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет. Это и есть первое правило ряда напряжений. Zn, Mg, Al давали реакцию замещения с кислотами (они находятся в ряду напряжений до Н), а Си нет (она после Н). Этот ряд имеет и ещё одно правило, оно тоже относится к реакциям замещения металлов, но только с растворами солей: если металл стоит в ряду напряжений до металла соли, то он способен вытеснить этот металл из раствора его соли (второе правило ряда напряжений). Вспомним правила обращения с лабораторным оборудованием и реактивами, т. Б.
Проводится лабораторный опыт “Замещение меди в растворе сульфата меди (II) железом”, и учащиеся записывают соответствующее уравнение:
Оформляем результаты лабораторного опыта в виде таблицы.
| Что делали | Что наблюдали |
По аналогии составляется уравнение реакции между алюминием и раствором хлорида меди (II):
2 А1 + 3 Сu С12 = 2 А1 С13 + 3 Сu
Необходимо показать, что здесь положение металла до и после Н уже не имеет значения, важно, чтобы вступающий в реакцию металл предшествовал металлу, образующему соль:
Серебро на медной монетке получается неэффектное – тёмный налёт, но если его натереть мягкой тряпочкой – монета заблестит, она стала посеребрённой.
В заключение учитель демонстрирует взаимодействие щелочных металлов и Са с водой.
Очень хорошо этот опыт получается с помощью кодоскопа. Чашечки Петри снизу подписываются фломастерами (Li, Na, Ca). В них наливается немного, на донышко, воды, куда добавляется фенолфталеин. Затем в каждую чашечку, стоящую на кодоскопе, опускается по кусочку (со спичечную головку) металла. Реакция проецируется на экран. Записываются соответствующие уравнения реакций:
Учащимся напоминается название подгруппы – “щелочные металлы”: теперь этимология названия подтверждена экспериментом.
III. Закрепление.
I уровень: определите типы химических реакций (на доске):
II уровень: вставьте вместо ? соответствующие химические формулы, расставьте коэффициенты и определите тип химических реакций.
III уровень: запишите химическую реакцию о которой идёт речь:
А) Магний взаимодействует при нагревании с оксидом кремния (IV), с
образованием оксида магния и кремния. Расставьте коэффициенты и укажите тип химической реакции.
Б) Вода взаимодействует с хлором, с образованием хлороводородной кислоты и кислорода. Расставьте коэффициенты и укажите тип химической реакции.
IV.Оценка эмоционального состояния.
Рефлексия.
- Что мы изучали сегодня на уроке – реакции замещения.
- Какие реакции называются реакциями замещения?
- С чего следует начинать расстановку коэффициентов, если в химической реакции
участвует соль. Ряд активности металлов. - Назовите два правила ряда активности металлов.
- Кто и когда открыл водород? (1766 год, Генри Кавендиш).
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

Реакция замещения в химии — как определить, признаки, примеры уравнений
Видео:8 класс. Составление уравнений химических реакций.Скачать

Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
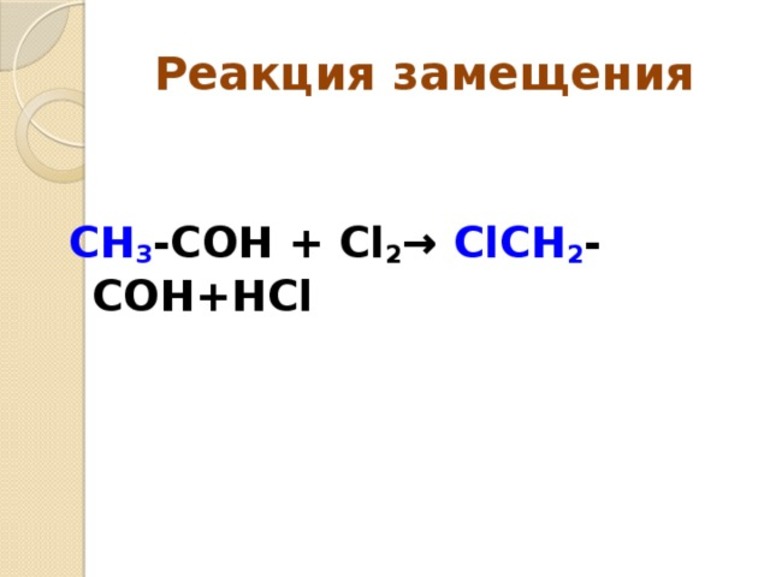
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
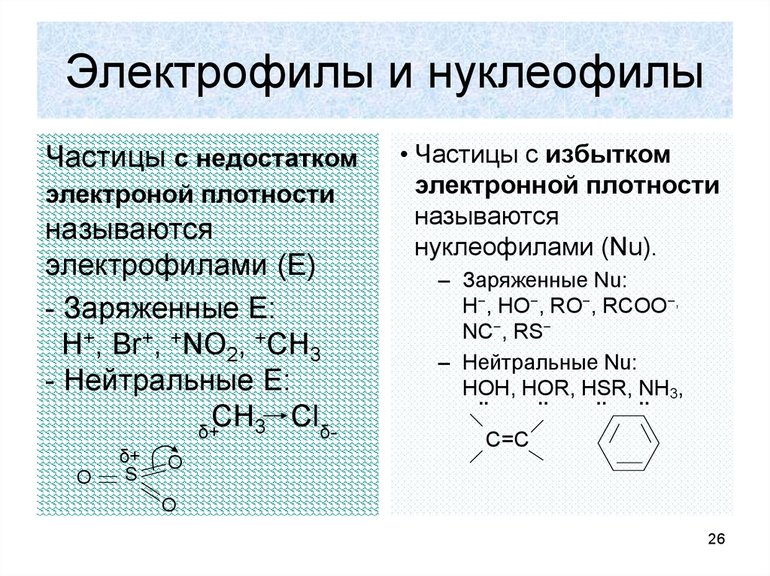
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
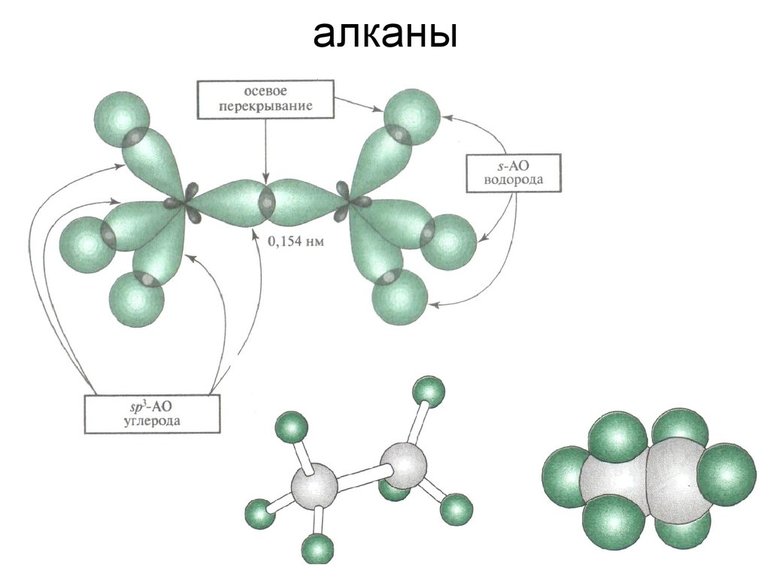
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Видео:Реакции замещенияСкачать

Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
🔍 Видео
Габриелян О. С. 8 класс §32 "Реакции замещения".Скачать

ХИМИЯ 8 класс : Реакции замещенияСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

8 класс - Химия - Реакция замещенияСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Механизм реакций замещения | Химия ЕГЭ 10 класс | УмскулСкачать