| Оксид олова II | |
|---|---|
 | |
| Систематическое наименование | оксид оловаII |
| Традиционные названия | монооксид олова; олово окись II, олово закись, олово одноокись |
| Хим. формула | SnO |
| Состояние | чёрный порошок |
| Молярная масса | 134.71 г/моль |
| Плотность | 6.45 г/см³ |
| Температура | |
| • плавления | (при 80 кПа) 1080 °C |
| • кипения | 1425 °C |
| • разложения | 1976 ± 1 °F [1] |
| • вспышки | негорюч °C |
| Мол. теплоёмк. | 47,8 Дж/(моль·К) |
| Теплопроводность | 47,8 Вт/(м·K) |
| Энтальпия | |
| • образования | -285,98 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. [1] |
| Растворимость | |
| • в воде | нерастворим |
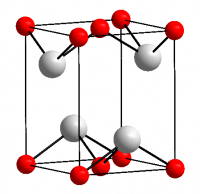
| Кристаллическая структура | тетрагональная |
| Рег. номер CAS | 21651-19-4 |
| PubChem | 88989 |
| Рег. номер EINECS | 244-499-5 |
| SMILES | |
| RTECS | XQ3700000 |
| ChemSpider | 80298 |
| Токсичность | при вдыхании вызывает кашель |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид олова II — неорганическое бинарное химическое соединение олова и кислорода, химическая формула SnO, черно-синие кристаллы (по другим данным коричневато-чёрные).
- Содержание
- Физические свойства
- Получение
- Химические свойства
- Применение
- Оксид олова (II): структура, свойства, номенклатура, применение
- Содержание:
- Растворимость
- Другие свойства
- Приложения
- При производстве других соединений олова (II)
- В украшениях
- Другое использование
- Последние нововведения
- Олово: степени окисления и реакции с ним
- Применение в промышленности
- Физические свойства олова
- Получение олова
- Химические свойства олова
- 📺 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Физические свойства
Темно-синие (почти чёрные) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
Из диоксида олова:
SnO2 + Sn → 1000oC 2 SnO
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
С помощью твёрдотельной реакции из хлорида олова II:
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Химические свойства
Оксид олова II устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
и концентрированных кислотах:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)3 2+ или Sn(OH)(OH2) 2+ , также в менее кислотных растворах — Sn3(OH)4 2+ .
Растворяется в концентрированных растворах щелочей и их расплавах:
SnO + NaOH + H2O ⇄ 20oC Na[Sn(OH)3] SnO + 2 NaOH → 400oC Na2SnO2 + H2O
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
2 SnO → 400oC SnO2 + Sn
Окисляется кислородом воздуха:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта:
Sn и O могут образовывать соединения нестехиометрического состава.
Видео:Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
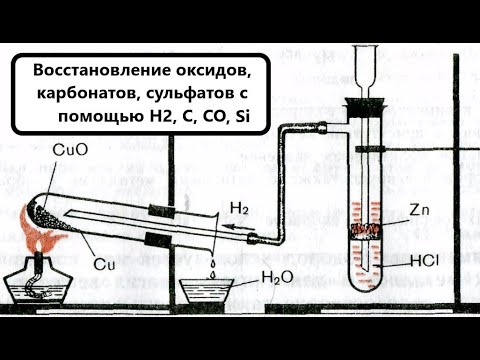
Применение
Оксид олова II в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия III с оксидом олова II используется в осветительных приборах как люминофор.
Видео:Взаимодействие хлорида олова (II) с цинком: "Оловянный ёжик"Скачать

Оксид олова (II): структура, свойства, номенклатура, применение
Оксид олова (II): структура, свойства, номенклатура, применение — Наука
Видео:Коррозия металла. Химия – ПростоСкачать

Содержание:
В оксид олова (II) представляет собой кристаллическое неорганическое твердое вещество, которое образуется в результате окисления олова (Sn) кислородом, при этом олово приобретает валентность 2+. Его химическая формула — SnO. Известны две различные формы этого соединения: черная и красная. Распространенной и наиболее устойчивой формой при комнатной температуре является черная или сине-черная модификация.
Эта форма получается гидролизом хлорида олова (II) (SnCl2) в водном растворе, к которому добавлен гидроксид аммония (NH4OH) для получения осадка гидратированного оксида Sn (II), формула которого SnO.xH2Или, где x 3
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Растворимость
Нерастворим в горячей или холодной воде. Нерастворим в метаноле, но быстро растворяется в концентрированных кислотах и щелочах.
Видео:Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Другие свойства
При нагревании до температуры более 300 ºC в присутствии воздуха оксид олова (II) быстро окисляется до оксида олова (IV), проявляя накал.
Сообщалось, что в неокислительных условиях нагревание оксида олова (II) дает разные результаты в зависимости от степени чистоты исходного оксида. Обычно непропорционально содержит металлический Sn и оксид олова (IV), SnO2, с различными промежуточными частицами, которые в конечном итоге становятся SnO2.
Оксид олова (II) является амфотерным, так как растворяется в кислотах с образованием ионов Sn. 2+ или анионных комплексов, а также растворяется в щелочах с образованием растворов гидрокситиннат-ионов Sn (OH)3 – , которые имеют пирамидальную структуру.
Кроме того, SnO является восстановителем и быстро реагирует с органическими и минеральными кислотами.
Он имеет низкую токсичность по сравнению с другими солями олова. Его LD50 (50% летальная доза или средняя летальная доза) для крыс составляет более 10 000 мг / кг. Это означает, что требуется более 10 граммов на килограмм, чтобы убить 50% образцов крыс за определенный период испытаний. Для сравнения, фторид олова (II) имеет LD50 у крыс 188 мг / кг.
Однако при длительном вдыхании он откладывается в легких, так как не всасывается и может вызвать станоз (проникновение пыли SnO в легкие).
Видео:Химическая реакция йода и алюминия.Скачать

Приложения
Видео:Хлорное олово. Хлористое олово. Станнан.Скачать

При производстве других соединений олова (II)
Его быстрая реакция с кислотами лежит в основе его наиболее важного использования — в качестве промежуточного продукта при производстве других соединений олова.
Он используется в производстве бромида олова (II) (SnBr2), цианид олова (II) (Sn (CN)2) и гидрат фторбората олова (II) (Sn (BF4)2) среди других соединений олова (II).
Фторборат олова (II) получают путем растворения SnO во фторборной кислоте и используют для покрытий из олова и свинца и олова, особенно при осаждении сплавов олово-свинец для пайки в электронной промышленности. Это связано, в том числе, с его высокой пропускной способностью.
Оксид олова (II) также используется при получении сульфата олова (II) (SnSO4), по реакции SnO и серной кислоты, H2ЮЗ4.
СнСО4 Полученный продукт используется в процессе лужения для производства печатных плат, для отделки электрических контактов и для лужения кухонной утвари.
Гидратированная форма SnO, гидратированный оксид олова (II) SnO.xH2Или его обрабатывают плавиковой кислотой для получения фторида двухвалентного олова (II), SnF2, который добавляют в зубные пасты как средство для борьбы с кариесами.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

В украшениях
Оксид олова (II) используется для получения кристаллов рубина золото-олово и медь-олово. Его функция в этом приложении, по-видимому, заключается в том, чтобы действовать как восстанавливающий агент.
Видео:КАК СДЕЛАТЬ ХЛОРИСТОЕ ОЛОВО (SnCl2) В ДОМАШНИХ УСЛОВИЯХ !Скачать

Другое использование
Он использовался в фотоэлектрических устройствах для производства электричества из света, таких как солнечные батареи.
Видео:Получение оловаСкачать

Последние нововведения
Упорядоченные наночастицы SnO использовались в электродах из углеродных нанотрубок для литий-серных батарей.
Электроды, изготовленные из SnO, демонстрируют высокую проводимость и небольшое изменение объема в повторяющихся циклах зарядки и разрядки.
Кроме того, SnO способствует быстрому переносу ионов / электронов во время окислительно-восстановительных реакций, которые происходят в таких батареях.
Видео:Восстанавливаем из раствора олова в металическое оловоСкачать

Олово: степени окисления и реакции с ним
Химические свойства олова
Олово – это легкий металл с атомным номером 50, который находится в 14-й группе периодической системы элементов. Этот элемент был известен еще в древности и считался одним из самых редких и дорогих металлов, поэтому изделия из олова могли позволить себе самые богатые жители Римской Империи и Древней Греции. Из олова изготавливали специальную бронзу, которой пользовались еще в третьем тысячелетии до нашей эры. Тогда бронза была самым прочным и популярным сплавом, а олово служило одной из примесей и использовалось более двух тысяч лет.
На латыни этот металл называли словом «stannum», что означает стойкость и прочность, однако таким названием ранее обозначался сплав свинца и серебра. Только в IV веке этим словом начали называть само олово. Само же название «олово» имеет множество версий происхождения. В Древнем Риме сосуды для вина делались из свинца. Можно предположить, что оловом называли материал свинец, из которого изготавливали сосуды для хранения напитка оловина, употребляемого древними славянами.
В природе этот металл встречается редко, по распространенности в земной коре олово занимает всего лишь 47-е место и добывается из касситерита, так называемого оловянного камня, который содержит около 80 процентов этого металла.
Видео:179 Взаимодействие оксида олова с цинкомСкачать

Применение в промышленности
Так как олово является нетоксичным и весьма прочным металлом, он применяется в сплавах с другими металлами. По большей части его используют для изготовления белой жести, которая применяется в производстве банок для консервов, припоев в электронике, а также для изготовления бронзы.
Видео:Магнийтермия: оксид олова (IV) с магнием / Thermic reaction: tin (IV) oxide with magnesiumСкачать

Физические свойства олова
Этот элемент представляет собой металл белого цвета с серебристым отблеском.
Если нагреть олово, можно услышать потрескивание. Этот звук обусловлен трением кристалликов друг о друга. Также характерный хруст появится, если кусок олова просто согнуть.
Олово весьма пластично и ковко. В классических условиях этот элемент существует в виде «белого олова», которое может модифицироваться в зависимости от температуры. Например, на морозе белое олово превратится в серое и будет иметь структуру, схожую со структурой алмаза. Кстати, серое олово очень хрупкое и буквально на глазах рассыпается в порошок. В связи с этим в истории есть терминология «оловянная чума».
Раньше люди не знали о таком свойстве олова, поэтому из него изготавливались пуговицы и кружки для солдат, а также прочие полезные вещи, которые после недолгого времени на морозе превращались в порошок. Некоторые историки считают, что именно из-за этого свойства олова снизилась боеспособность армии Наполеона.
Видео:Взаимодействие оксида олова с цинкомСкачать

Получение олова
Основным способом получения олова является восстановление металла из руды, содержащей оксид олова(IV) с помощью угля, алюминия или цинка.
Особо чистое олово получают электрохимическим рафинированием или методом зонной плавки.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химические свойства олова
При комнатной температуре олово довольно устойчиво к воздействию воздуха или воды. Это объясняется тем, что на поверхности металла возникает тонкая оксидная пленка.
На воздухе олово начинает окисляться только при температуре свыше 150 °С:
Если олово нагреть, этот элемент будет реагировать с большинством неметаллов, образуя соединения со степенью окисления +4 (она более характерна для этого элемента):
Взаимодействие олова и концентрированной соляной кислоты протекает довольно медленно:
Sn + 4HCl → H₂[SnCl₄] + H₂
С концентрированной серной кислотой олово реагирует очень медленно, тогда как с разбавленной в реакцию не вступает вообще.
Очень интересна реакция олова с азотной кислотой, которая зависит от концентрации раствора. Реакция протекает с образованием оловянной кислоты, H₂SnO₃, которая представляет собой белый аморфный порошок:
3Sn + 4HNO₃ + nH₂O = 3H₂SnO₃·nH₂O + 4NO
Если же олово смешать с разбавленной азотной кислотой, этот элемент будет проявлять металлические свойства с образованием нитрата олова:
4Sn + 10HNO₃ = 4Sn(NO₃)₂ + NH₄NO₃ + 3H₂O
Нагретое олово нагреть может реагировать со щелочами с выделением водорода:
Sn + 2KOH + 4H₂O = K₂[Sn(OH)₆] + 2H₂
Здесь вы найдете безопасные и очень красивые эксперименты с оловом.
Степени окисления олова
В простом состоянии степень окисления олова равняется нулю. Также Sn может иметь степень окисления +2: оксид олова(II) SnO, хлорид олова(II) SnCl₂, гидроксид олова(II) Sn(OH)₂. Степень окисления +4 наиболее характерна для оксида олова(IV) SnO₂, галогенидах(IV), например хлорид SnCl₄, сульфид олова(IV) SnS₂, нитрид олова(IV) Sn₃N₄.
📺 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

