- Реакция взаимодействия оксида индия (III) и водорода
- Реакция взаимодействия кальция и водорода
- Реакция взаимодействия карбоната лития и магния
- Реакция термического разложения хлорида золота (I)
- Выбрать язык
- Разделы
- ТОП 5 записей
- Популярные записи
- Элементы, реакции, вещества
- Предупреждение.
- ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ
- ГДЗ химия 11 класс Радецкий, дидактический материал, тема 5, раб 1, вариант 3, 1 задание. Дайте уравнения реакций
- 🎥 Видео
Видео:Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Реакция взаимодействия оксида индия (III) и водорода
Уравнение реакции взаимодействия оксида индия (III) и водорода:
Реакция взаимодействия оксида индия (III) и водорода.
В результате реакции образуются индий и вода.
Реакция протекает при условии: при температуре около 700 °C.
Формула поиска по сайту: In2O3 + 3H2 → 2In + 3H2O.
Реакция взаимодействия кальция и водорода
Реакция взаимодействия карбоната лития и магния
Реакция термического разложения хлорида золота (I)
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ
В соответствии с электронной конфигурацией атома 4d 10 5s 25 5p 1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно).
На воздухе в твердом компактном состоянии индий стоек, но окисляется при высоких температурах, а выше 800 °C горит фиолетово-синим пламенем, давая оксид In2O3 — желтые кристаллы, хорошо растворимые в кислотах.
При нагревании индий легко соединяется с галогенами, образуя растворимые галогениды InCl3, InBr3, InI3. Нагреванием индия в токе HCl получают хлорид InCl2, а при пропускании паров InCl2 над нагретым In образуется InCl.
С серой индий образует сульфиды In2S3, InS; они дают соединения InS·In2S3 и 3InS·In2S3. В воде в присутствии окислителей индий медленно корродирует с поверхности:
4In + 3O2+6H2O = 4In(ОН)3.
В кислотах индий растворим, его нормальный электродный потенциал равен -0,34 в, в щелочах практически не растворяется.
Слабоосновной оксид индия In2O3 в воде практически нерастворим, но легко растворяется в кислотах:
Соли индия легко гидролизуются; продукт гидролиза — основные соли или гидрооксид In(OH)3. Гидроксид индия получают, действуя раствором аммиака на соли индия. Основные свойства у In(OH)3 преобладают над кислотными.
In(OH)3 — хорошо растворим в кислотах и плохо — в растворах щелочей, с образованием солей — индатов
Соединения индия низших степеней окисления довольно неустойчивы; галогениды InHal и черный оксид In2O — очень сильные восстановители [4].
Применяют для нанесения покрытий на поверхность зеркал, рефлекторов и подшипников. Индий — легирующая добавка к полупроводниковым германию и кремнию.
Герметизирующий материал в вакуумных приборах и космических аппаратах, материал для соединения пьезоэлектрических кристаллов. Используется как компонент легкоплавких сплавов, применяемых в качестве припоев, в термоограничителях, предохранителях, сигнальных устройствах, в радиационных контурах ядерных реакторов[4].
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ГДЗ химия 11 класс Радецкий, дидактический материал, тема 5, раб 1, вариант 3, 1 задание. Дайте уравнения реакций
Напишите уравнения реакций: а) получения меди из оксида меди(Н) путём восстановления водородом; б) получения железа из оксида железа(III) путём восстановления оксидом углерода(Н); в) получения ванадия из оксида ванадия(V) кальцийтермическим способом. Реакцию в разберите как окислительно-восстановительную: обозначьте степени окисления атомов и расставьте коэффициенты, определив их методом электронного баланса.
🎥 Видео
Реакция восстановления Берча IСкачать

Восстановление меди водородом из оксида меди (II)Скачать

Водород/химические свойства водорода/8 классСкачать

Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
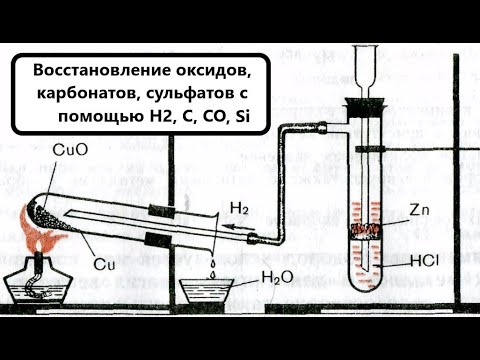
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

25. Схема реакции и химическое уравнениеСкачать

Уравнивание реакций горения углеводородовСкачать

9 класс § 7 "Окислительно-восстановительные реакции"Скачать

Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

Взаимодействие оксида меди с водородом (CuO + H2 = H2O + Cu)Скачать

Окислительно восстановительные реакции | Химия 8 класс #52 | ИнфоурокСкачать

Окислительно-восстановительные реакции. Опыт 1Скачать

Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Составление уравнений реакций горения. 11 класс.Скачать

Окислительно-восстановительные реакции - НЕОРГАНИКА | ЕГЭ химияСкачать

6 Восстановление оксида меди водородомСкачать
