| Малеиновая кислота | |||
|---|---|---|---|
| |||
| Систематическое наименование | цис-бутендиовая кислота | ||
| Традиционные названия | малеиновая кислота | ||
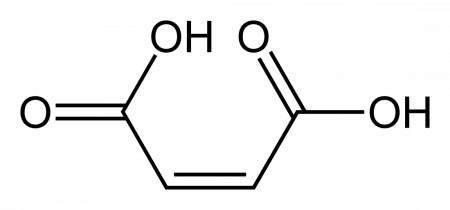
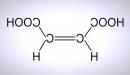
| Хим. формула | HOOC-CH=CH-COOH | ||
| Рац. формула | H4C4O4 | ||
| Состояние | твердое | ||
| Молярная масса | 116,07 г/моль | ||
| Плотность | 1,59 г/см³ | ||
| Температура | |||
| • плавления | 135 °C | ||
| • разложения | 135 °C | ||
| • вспышки | 127 °C | ||
| Константа диссоциации кислоты pKa | pka1 = 1,9 pka2 = 6,07 | ||
| Растворимость | |||
| • в воде | 78,8 г/100 мл | ||
| ГОСТ | ГОСТ 9803-75 | ||
| Рег. номер CAS | 110-16-7 | ||
| PubChem | 444266 | ||
| Рег. номер EINECS | 203-742-5 | ||
| SMILES | |||
| RTECS | OM9625000 | ||
| ChEBI | 18300 | ||
| ChemSpider | 392248 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Малеиновая кислота — органическое соединение с формулой HOOC-CH=CH-COOH. Двухосновная непредельная кислота.
Название по номенклатуре IUPAC — цис-бутендиовая кислота. Её транс-изомер называется фумаровой кислотой.
Соли и сложные эфиры малеиновой кислоты называются малеаты.
Наиболее часто она используется для получения фумаровой кислоты.
- Содержание
- Физические свойства
- История и методы синтеза
- Производство в промышленности
- Применение в промышленности
- Другие реакции
- Малеиновая кислота. Свойства, получение, применение и цена малеиновой кислоты
- Свойства малеиновой кислоты
- Применение малеиновой кислоты
- Получение малеиновой кислоты
- Цена малеиновой кислоты
- Кислота малеиновая: формула, свойства
- Общие характеристики
- Получение вещества
- Вступление в реакции
- Применение
- Получение фумаровой кислоты
- Применение фумарового соединения
- 📺 Видео
Видео:65. Что такое реакция гидратации и реакция дегидратацииСкачать

Содержание
- 1 Физические свойства
- 2 История и методы синтеза
- 3 Производство в промышленности
- 4 Применение в промышленности
- 5 Другие реакции
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Физические свойства
Молекула малеиновой кислоты менее стабильна чем фумаровой кислоты. Разница их теплот сгорания равна 22,7 кДж/моль.
Малеиновая кислота хорошо растворима в воде (78,8 г/л при 25 °C), а фумаровая кислота — плохо (6,3 г/л при 25 °C). Эти свойства объясняются образованием внутримолекулярной водородной связи в молекуле малеиновой кислоты.
Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

История и методы синтеза
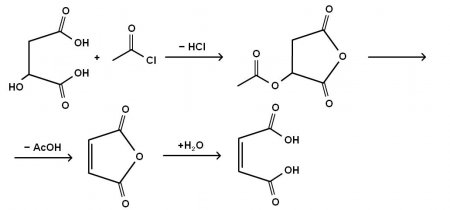
Малеиновая кислота впервые была получена Лассэнем в 1819 г. перегонкой яблочной кислоты. По Перкину (1881 г.), для её получения яблочную кислоту обрабатывают ацетилхлоридом, получая ацетил-яблочный ангидрид, который разлагается с образованием уксусной кислоты и малеинового ангидрида, гидратацией которого получают малеиновую кислоту.
Общая схема процесса:
Видео:Карбоновые кислоты. Химические свойства (часть 2). Химия 10 классСкачать

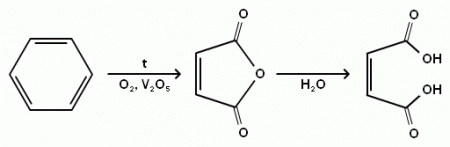
Производство в промышленности
В промышленности малеиновую кислоту получают гидролизом малеинового ангидрида, который получают каталитическим окислением бензола по схеме:
Видео:25. Схема реакции и химическое уравнениеСкачать

Применение в промышленности
Наиболее важным применением малеиновой кислоты является использование её в производстве фумаровой кислоты. Для производства фумаровой кислоты малеиновою кислоту каталитически (катализаторы — тиомочевина, неорганические кислоты) изомеризуют. Очень малая растворимость фумаровой кислоты сильно упрощает её отделение от непрореагировавшей малеиновой кислоты. Эти кислоты являются геометрическими изомерами, они не могут самопроизвольно превращаться одна в другую. Это объясняется тем, что для их взаимопревращение нужно разорвать π связь между атомами углерода. Путём озонолиза малеиновою кислоту превращают в глиоксиловою кислоту.
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Другие реакции
Малеиновою кислоту можно превратить в яблочную кислоту путём гидратации, в янтарную кислоту путём гидрирования, в малеиновый ангидрид путём дегидратации. Вышеперечисленные реакции не используются в промышленности для производства перечисленных веществ, потому что они являются экономически невыгодными.
Видео:Реакции кислот-окислителей со сложными веществами: как понять? | Химия ЕГЭ 2022 | УмскулСкачать

Малеиновая кислота. Свойства, получение, применение и цена малеиновой кислоты
Цис-бутендиовая. Так малеиновая кислота называется в номенклатуре Международного союза теоретической и прикладной химии. Приставка «цис» указывает, что заместители в молекуле вещества находятся по одну сторону от атомов с двойной связью.
Если есть цикл, смотрят, с какой стороны заместители относительно его оси. Циклом именуют ряд атомов, объединенных в кольцо . В молекуле малеинового соединения таковых нет, поэтому ориентируются по двойной связи между центральными атомами углерода .
Их наличие говорит об органической природе вещества. На это указывает и присутствие в названии кислоты бутена – непредельного углеводорода. Он входит в состав соединения. Окончание «диовая» говорит, что в кислоте две карбоксильных группы СООН. Значение имени расшифровано. Перейдем к знакомству с сутью.
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Свойства малеиновой кислоты
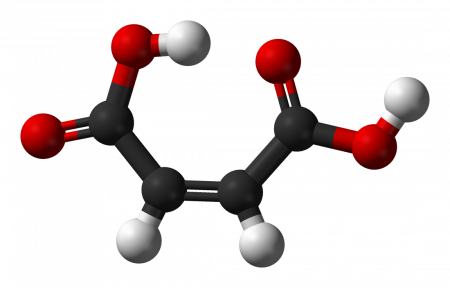
Формула малеиновой кислоты: — HOOC-CH=CH-COOH. Простая запись: — С4Н4О4. Такая же формула соответствует фумаровой кислоте . Но, построение атомов в ней иное. Фумаровое соединение является транс-изомером. Это значит, что заместители расположены по разные стороны оси. В малеиновой же кислоте они с одной стороны. Для наглядности приведем обе пространственные формулы:
Поскольку в героини статьи присутствуют внутримолекулярные водородные связи, малеиновая кислота свойство имеет растворяться в воде. Фумаровое вещество на это не способно.
Малеиновая же кислота растворяется в количестве 78,8 граммов на 100 миллилитров воды. Реакция проходит при комнатной температуре. Для растворения в ацетоне, этаноле и диэтиловом эфире тоже достаточно обычных условий.
Внешне кислота – кристаллическое вещество. Белый порошок кисловат, плавится уже при 135-ти градусах Цельсия. Если же довести до кипения, образуются едкие пары, дым. Закипает она при 280-ти градусах. Для фумарового двойника – это лишь температура плавления. К тому же, фумаровое соединение устойчиво, чего не скажешь о малеиновом.
Малеиновая кислота легко переходит в другие кислоты . Для превращения нужен солнечный свет. В его присутствии из малеиновой получаются, к примеру, фумаровая и янтарная кислоты .
Неустойчивость её не беспокоит промышленников, поскольку они используют не чистое вещество, а ангидрит малеиновой кислоты. Он устойчив. Получают ангидрит, окисляя н-бутан, или бензол. Устойчивы, так же, эфиры малеиновой кислоты. Они тоже имеют практическое применение. Какое, расскажем в следующей главе.
Видео:Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

Применение малеиновой кислоты
Применение малеинового соединения актуально лишь для получения фумаровой кислоты . В остальных сферах производства используются производные героини статьи. Так, малеиновый ангидрид ценится строителями.
Из реагента делают алкидные и полиэфирные смолы. Они способны упрочнить покрытия на масляной основе. В красках смолы служат преградой для коррозии металлов . Поэтому, именно алкидными и полиэфирными составами покрывают морские приборы, трактора, типографскую аппаратуру.
Полиэфирные смолы, так же, — сырье для изготовления стеклопластика, прочих полимеров. Даже искусственный камень, и тот, делают на основе малеинового ангидрида. Он же нужен для покрытия фасадов и создания бетона. В последний ангидрид добавляют для придания смеси пластичности.
Ангидрид включен в класс сополимеров малеиновой кислоты. На их основе формируют искусственные волокна и ряд синтетических тканей. Формируются на основе ангидрида и сельскохозяйственные культуры. Сополимер регулирует их рост, ускоряя его.
Эфиры малеиновой кислоты служат растворителями. Особенно широко применение диэтилмалеата. Его закупают и для лакокрасочной продукции, и для оборонных предприятий, и для химических лабораторий. Растворитель нужен, так же, фармацевтам, парфюмерам и на нефтегазовых предприятиях.
Гидразит малеиновой кислоты – еще одно полезное соединение героини статьи. Используется гидразит в качестве гербицида. Его действие избирательно, то есть, поражает лишь сорные травы.
Правда, из почвы гидразит попадает и в культурные растения. Однако, для теплокровных соль малеиновой кислоты нетоксична. На килограмм продукции допускают 14-граммовое содержание гербицида.
Хоть разрешенная норма и внушительна, лучше не перебарщивать с реагентом. Малеиновая кислота относится к сильным. Попадая на кожу, соединение разъедает ее. То же делают пары кислоты , но уже со слизистыми.
Поэтому, вещество отнесено к умеренно токсичным. Попадая в организм в разумных дозах, малеиновая кислота быстро выводится и не приносит вреда . В общем, в потреблении реагента нужно искать золотую середину.
Только вот подвох заключается в том, что как пищевая добавка соединение не числится. Узнать, сколько кислоты в растительной пище, молоке, мясе, можно лишь проведя экспертизу.
Видео:78. Что такое реакции полимеризацииСкачать

Получение малеиновой кислоты
В природе героиня статьи не встречается. Не удивительно, учитывая неустойчивость соединения. Если промышленникам нужно именно оно, к примеру, для получения фумаровой версии, используют малеиновый ангидрит. Проводят его гидролиз. Это разложение вещества посредством воды.
Впервые малеиновое соединение получили в 1819-ом году, перегоняя яблочную кислоту . В процессе, ее обрабатывают ацетилхлоридом. Это пахучая, летучая жидкость. Реакция приводит к ацетил-яблочному ангидриду.
Кстати ангидридами именуют солеобразующие оксиды. Ацетил-яблочный разлагается до уксусной кислоты и малеинового ангидрида. Далее, следует стандартная гидратация с получением героини статьи. То есть, первоначальная добыча кислоты не особо отличается от современной методики. В виде графических формул ее представляют так:
Видео:Опыты по химии. Реакция нейтрализацииСкачать

Цена малеиновой кислоты
Цена малеиновой кислоты доступна. Именно поэтому вещество полюбилось промышленникам. Затраты на получение соединения минимальны, а прок от него велик. Продают, в основном, производные кислоты .
Так, за килограмм ангидрида просят около 200-от рублей . Чистая кислота стоит, как правило, дешевле. За кило просят примерно 150 рублей. При этом, идет приписка «ЧДА».Эта аббревиатура означает «Чистый для анализа».
То есть, ценник выставляется за кислоту без сторонних примесей. Если брать техническую, можно обойтись тратами в 70-100 рублей за каждую 1 000 граммов.
Видео:Все задания №32 из сборника ЕГЭ 2023 (часть 2) | Химия ЕГЭ для 10 класса | УмскулСкачать

Кислота малеиновая: формула, свойства
Малеиновая кислота была впервые получена почти 200 лет тому назад. Ее удалось синтезировать посредством перегонки яблочной кислоты. В дальнейшем она нашла свое применение в химической области, и об этом стоит рассказать в подробностях. Впрочем, сначала речь пойдет о ее свойствах и прочих особенностях.
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Общие характеристики
Формула малеиновой кислоты выглядит так: НООС-СН=СН-СООН (или H4C4O4). Данное вещество представляет собой органическое соединение с двумя основами. В соответствии с номенклатурой IUPAC, его правильно называть цис-бутендиовой кислотой.
Характеристики данного вещества можно выделить в следующий перечень:
· Молярная масса составляет 116,07 г/моль.
· Плотность равна 1,59 г/см³.
· Температура плавления и разложения достигает 135 °C. Вспышка происходит при 127 °C.
· Показатель растворимости в воде составляет 78,8 г/л. Лучше всего этот процесс осуществляется при 25°C.
У данного вещества есть транс-изомер, и он известен как фумаровая кислота. Ее молекулы более стабильны, чем у малеиновой. Отсюда и разница в показателях температуры сгорания, составляющая 22,7 кДж/моль.
А еще фумаровая кислота, в отличие от малеиновой, очень плохо растворяется в воде. Всего 6,3 г/л. Это объясняется тем, что в малеиновых молекулах образуется водородная связь.
Видео:Взаимосвязь органических веществ (вопрос 16 и 33 в заданиях ЕГЭ-2019)Скачать

Получение вещества
Получение малеиновой кислоты осуществляется посредством гидролиза ангидрида C4H2O3. Он представляет собой органическое соединение, имеющее в чистом состоянии твердую консистенцию. Это вещество, как правило, бесцветное или белое.
У ангидрида очень разнообразные химические свойства, ведь он имеет крайне высокую реакционную способность и две функциональные группы. Малеиновая кислота образуется вследствие его взаимодействия с водой. А вот если соединить его со спиртами, то получатся неполные эфиры.
Сам ангидрид раньше синтезировали посредством окисления бензола или иных ароматических соединений. Сейчас этот метод используют редко. Из-за выросших на бензол цен и влияния этого вещества на экологическую среду, его заменили н-бутаном – углеводородом класса алканов.
Видео:Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

Вступление в реакции
Стоит отметить, что малеиновую кислоту реально превратить в яблочную. Это достигается посредством гидратации – присоединением молекул воды к ионам/частицам основного вещества. Яблочная кислота известна как пищевая добавка под обозначением Е296. У нее природное происхождение, так что она используется в кондитерском деле и в производстве фруктовых вод. Еще она применима в медицине.
Также малеиновое соединение можно превратить и в янтарную кислоту, которую используют для стимуляции роста растений и повышения урожая. Впервые ее получили в XVII столетии перегонкой янтаря. А сейчас данное вещество синтезируют гидрированием малеиновой кислоты. То есть путем присоединения к ней водорода. А посредством дегидратации (отщеплением воды от молекул) из нее можно получить ангидрид малеиновой кислоты.
Все перечисленные реакции теоретически могли бы использоваться в промышленности для производства указанных веществ. Вот только они экономически невыгодны, поэтому к ним не прибегают.
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Применение
Сложно переоценить свойства малеиновой кислоты. Сама она используется лишь для получения фумарового соединения, но вот применение ее производных распространено широко:
· Ангидрид задействован в изготовлении полиэфирной продукции. Смол, в частности. Конечные продукты активно применяются в сфере строительства. Это ЛКМ, искусственный камень, стеклопластики и т. д.
· Реагенты используются для изготовления алкидных смол, которые отлично упрочняют покрытия на масляной основе. Они применяются и в качестве антикоррозийного покрытия.
· Также из ангидрида, поскольку он является сополимером малеиновой кислоты, делают синтетические ткани и искусственные волокна.
· Эфиры данного вещества используют в качестве растворителей. Самым распространенным является диэтилмалеат. Его используют химические лаборатории, оборонные предприятия, а также в сфере лакокрасочной продукции.
· Гидразит малеинового соединения используют как гербицид. Он отлично поражает сорные травы.
Видео:11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать

Получение фумаровой кислоты
О нем тоже необходимо сказать пару слов. Чтобы получить фумаровую кислоту, малеиновую каталитически изомеризуют. Данный процесс осуществляется с применением тиомочевины (тиокарбамид). Хотя нередко ее заменяют неорганическими кислотами.
Поскольку фумаровое соединение плохо растворяется, его легко выделить из малеинового вещества. Обе кислоты относятся к конформерам – имеют одинаковое количество атомов и молекул, а также схожую структуру. Но, несмотря на это, они не могут превращаться друг в друга самопроизвольно. Чтобы данный процесс произошел, надо разорвать углеродную двойную связь, но это невыгодно с энергетической точки зрения.
Так что в промышленности используется способ, уже упомянутый ранее – каталитическая изомеризация малеинового соединения в воде.
Видео:117. Реакция диспропорционирования (дисмутации).Скачать

Применение фумарового соединения
Об этом стоит рассказать напоследок. Дольше всего фумаровая кислота используется в пищевой промышленности. Впервые ее применили в 1946 году. Это соединение имеет фруктовый вкус, поэтому его часто используют в качестве подсластителя. Обозначается Е297.
Еще фумаровой кислотой нередко заменяют винную и лимонную. Это экономически выгодно. Если добавлять цитрат, то для достижения нужного вкусового эффекта понадобится 1.36 г. Фумарата нужно меньше – всего 0.91 г.
Также эфиры данного вещества применяются в процессе лечения такого кожного заболевания, как псориаз. Для взрослого человека установлена дневная норма в 60-105 миллиграмм (точная доза зависит от индивидуального случая). Может быть увеличена со временем до 1300 мг в день.
А соль данного вещества является ключевым компонентом таких препаратов, как «Конфумин» и «Мафусол». Первый помогает организму адаптироваться к недостатку кислорода и регулирует метаболизм. А второй улучшает реологические свойства крови и ее вязкость.
Интересно, что даже человеческий организм способен синтезировать фумарат. Он образуется кожей, когда на нее оказывается воздействие солнечного света. К тому же фумарат – это побочный продукт цикла мочевины.
📺 Видео
ЕГЭ по химии: редкие реакции (органика)Скачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать