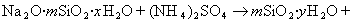В исследовательской практике золи получают как физическими методами конденсации, так и химическими. В ряде случаев можно получать золи непосредственной конденсацией паров, например, ртути, серы, селена и других веществ, не окисляющихся при испарении. В тех случаях, когда при испарении на воздухе возможно окисление, проводят одновременное испарение в вакууме как дисперсной фазы, так и дисперсионной среды, после чего конденсируют их на охлажденной поверхности, а затем нагревают до расплавления дисперсионной среды и получают лиозоль. Таков, например, метод Рогинского и Шальникова получения органозолей щелочных металлов.
Для образования золей из растворов используют метод снижения растворимости, например, так называемый метод замены растворителя. Можно вливать раствор вещества в растворителе, неограниченно смешивающимся с водой, в охлажденную воду или изменять растворяющую способность, вводя осадитель в водный раствор. Такой метод применяется не только для получения золей, но и при формовании волокон из растворов.
Можно получать золи путем охлаждения пересыщенных водных растворов, например, вливанием горячего раствора в холодную воду. В тех случаях, когда растворенное вещество имеет на кривой растворимости критическую температуру смешения, вблизи этой температуры при охлаждении или нагревании образуется лиофильный золь.
Наиболее важное значение для технологии получения дисперсных систем имеют процессы конденсации в жидкой среде, основанные на образовании дисперсной фазы при химическом взаимодействии растворимых веществ. Необходимым условием получения лиозолей является малая растворимость дисперсной фазы.
В принципе может быть использована любая химическая реакция — восстановления, окисления, двойного обмена, гидролиза. Во время становления коллоидной химии как науки было предложено бесконечное число химический реакций, которые могут привести к образованию коллоидных систем. Большинство способов получения золей были обобщены Зигмонди. Мы остановимся только на тех, которые имеют промышленное значение. Например, при химической очистке воды перед использованием ее в технологических процессах используют реакцию гидролиза солей железа или алюминия:
Fe 3+ + H2O Þ [Fe(OH)] 2+ + H + , (2.1.53)
Полный гидролиз солей железа (III) протекает медленно и равновесие достигается за пять — шесть месяцев. Поэтому в золях гидроксида железа (III) формируются частицы переменного состава. В технологической практике часто используют соль железа (II) — железный купорос FeSO4·7H2O, гидролиз которого можно описать схемой
Гидроксид железа (II) Fe(OH)2 хорошо растворим в воде, поэтому для перевода его в гидроксид железа (III) требуется создавать щелочную среду, например, при использовании гидроксида кальция. Гидролиз ускоряется при нагревании. Мицелла гидроксида железа (III) может быть изображена схемой
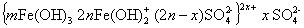
Промежуточными продуктами, стабилизирующими золь, могут быть в кислой среде
Cтепень гидролиза зависит от концентрации солей и температуры. В щелочной среде в зависимости от степени гидролиза возможны такие промежуточные продукты как
В этой связи строение мицеллы гидроксида алюминия может быть изображена схемой:
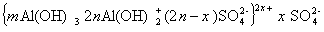
в щелочной среде
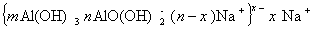
Таким образом, частицы гидроксида алюминия могут нести отрицательный или положительный заряд в зависимости от рН среды. Как установил Кольтгоф точка электрической нейтральности (точка нулевого заряда) золя гидроксида алюминия соответствует рН = 6,5¸7,5. Наибольшая скорость гидролиза солей алюминия наблюдается при рН = 4,95¸5,40.
В процессах беления текстильных материалов в качестве стабилизатора пероксида водорода используют силикат натрия. Стабилизирующее действие связывают обычно с образованием золя оксида кремния. Можно полагать. что в щелочной среде образуется кремнезоль, мицеллы которого изображают схемой
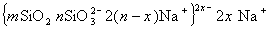
Стабилизирующие ионы SiO3 2 — образуются при диссоциации поверхностных групп Na2O2SiO-, а диоксид кремния, достраивающий ядро мицеллы, образуется в результате реакций
Ионы Н + , образующиеся при распаде пероксида водорода, связываются с силикатом, имеющим высокую буферную емкость. В присутствии солей жесткости Са 2+ или Mg 2+ возможна коагуляция гидрозоля и образование силикатных осадков, что влечет за собой проблемы, связанные с отложением коагулюма на тканях и деталях оборудования. Гидролиз силиката с образованием диоксида ускоряется при нагревании, в частности, паром отбеливаемой ткани, пропитанной белящим раствором, содержащим в качестве стабилизатора пероксид силиката натрия. Осадки диоксида кремния на ткани, возникающие при коагуляции кремнезоля, могут привести к непрокрасу ткани и ухудшают ее гриф.
Приведенная схема получения золя диоксида кремния только приближенно описывает процесс, так как силикат натрия часто находится в полимеризованном виде Na2O·mSiO2·xH2O.
В практике очистки воды от первичных загрязнений используют золи диоксида кремния, которые получают из активной кремнекислоты, а ту, в свою очередь, образуют из силиката натрия при использовании различных реакций, например
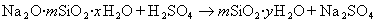
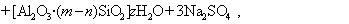
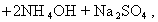
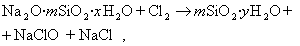
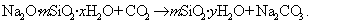
Частицы золей активной кремнекислоты состоят из разветвленных цепочек или колец тетраэдров SiO2, соединенных силоксановыми связями =Si-O-Si=. На поверхности частиц сохраняются атомы кремния, связанные с группами =Si-OH. В результате диссоциации этих групп поверхность частиц приобретает отрицательный заряд, а вокруг частиц диффузионно располагаются катионы. Схему мицеллы золей диоксида кремния, полученной по любой из приведенных реакций, можно изобразить одной и той же формулой
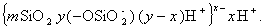
По реакции (2.1.67) наряду с золем диоксида кремния образуется золь алюмосиликата. Все эти золи имеют отрицательный заряд частиц и используются обычно для улучшения коагуляции положительно заряженных золей гидроксидов алюминия и железа с целью уменьшения объема образующихся осадков и повышения качества очистки воды.
При синтезе коллоидных систем в аппаратах, применяемых при очистке сточных вод от красителей, текстильно-вспомогательных веществ и ПАВ, в присутствии хлорида натрия или сульфата натрия получают золи гидроксидов железа или алюминия в результате следующих реакций на электродах:
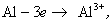
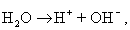

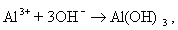
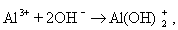
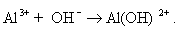
Мицеллы имеют переменный состав в зависимости от степени окисления алюминия
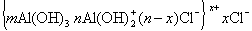
В результате такого процесса формируются положительно заряженные частицы, необыкновенно адсорбционно-активные в момент образования, поэтому способные к замещению противоионов Cl — анионами красителей или анионактивными ПАВ. После такого замещения агрегативная устойчивость нарушается и золи коагулируют.
Аналогичная схема может быть использована и при получении золей гидроксида железа. Как недостаток метода можно отметить выделение водорода при электролизе воды, в результате чего возникает опасность взрыва.
Если при получении лиозолей (в воде или какой-либо другой полярной или неполярной жидкости) образуются коллоидные частицы, не имеющие на своей поверхности достаточного для агрегативной устойчивости количества стабилизатора, или в водной фазе находится избыток электролита, то коллоидные частицы при взаимодействии друг с другом сформируют осадок.
Этот осадок может быть вновь переведен в устойчивое состояние с образованием лиозоля при восстановлении структуры стабилизирующего слоя на поверхности частиц или его создании. Такой процесс называют пептизацией. Пептизация может происходить при промывке осадков от излишнего электролита, при введении химически активного компонента, при добавлении электролита, ионы которого способны достраивать частицу, или при добавлении ПАВ, которые на поверхности частиц формируют адсорбционно-сольватные оболочки. Таким образом, пептизация — это процесс получения лиозолей из осадков частиц, уже имеющих коллоидный размер. Следовательно, этот способ образования лиозолей не относится ни к диспергационным, ни к конденсационным.
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Методы получения коллоидных растворов
Получение коллоидных растворов (золей) требует соблюдения следующих условий: 1) нерастворимость веществ дисперсной фазы в дисперсионной среде; 2) наличие в среде стабилизаторов — веществ, способных стабилизировать дисперсные частицы.
Получить коллоидные растворы можно измельчением вещества до коллоидного состояния (диспергация) и укрупнением молекул и ионов в агрегаты коллоидных размеров (конденсационные методы).
Диспергирование проводят физическими методами: механическим, ультразвуковым, электрическим.
Механическое диспергирование — дробление, истирание проводят в шаровых мельницах при медленном вращении полого цилиндра, заполненного на 30—40% шарами из стали, камня или фарфора. Более тонкое раздробление проводят коллоидными мельницами, где в зазоре между быстро вращающимся ротором и неподвижным кожухом происходит истирание частиц. Использование поверхностно-активных веществ при получении коллоидных растворов диспергированием определяется их способностью понижать сопротивление твердых тел механическому разрушению (эффект Ребиндера, 1928 г.). ПАВ облегчает развитие микротрещин в поверхностных слоях разрушаемого тела, чем способствует повышению степени дисперсности.
Диспергирование ультразвуком происходит за счет возникновения разрывающих усилий при прохождении через твердое тело колебаний с частотой 20000 Гц/с. Этот метод применяют для диспергирования серы, графита, красок.
Коллоидные растворы металлов получают электрическим диспергированием путем распыления в вольтовой дуге металлических электродов, погруженных в воду.
Рыхлые, студенистые, свежеприготовленные осадки можно диспергировать химическим методом пептизации — промыванием небольшим количеством раствора пептизатора с образованием высокодисперсной системы. При этом нарушаются связи между слипшимися частицами, частицы приобретают заряд вследствии диссоциации.
Условием получения коллоидных растворов конденсационными методами является получение пересыщенных систем физическими или химическими методами. Такие системы образуются при конденсации паров, например, ртути при получении гидрозоля ртути и некоторых других металлов.
Пересыщенные растворы можно получить методом заучены растворителя, вследствие низкой растворимости вещества в новом растворителе. Так, из исходных спиртовых растворов получают коллоидные растворы серы, фосфора, канифоли в воде.
Химической конденсацией получают дисперсную фазу в ходе реакций обмена, окисления-восстановления, гидролиза. Например, в кипящей воде в результате гидролиза солей железа(Ш) можно получить коллоидные частицы его гидроксида:
Для повышения устойчивости коллоидов в раствор вводят стабилизаторы — ионы вещества, из которого состоит частица. Например, если при получении золя иодида серебра но уравнению
растворы нитрата серебра и иодида калия взяты в эквивалентных количествах, то устойчивой коллоидной системы не образуется. Образующиеся частицы не несут электрических зарядов, т.е. L, = 0. Чтобы получить коллоидный раствор иодида серебра, необходимо взять избыток одного из электролитов, который станет по- тенциалопределяющим, придаст частицам заряд, стабилизирует коллоидную систему. Например, избыток нитрата серебра ведет к образованию положительно заряженных коллоидных частиц в результате адсорбции ионов Ag + .
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Конденсационные методы получения коллоидных систем
Из классификации дисперсных систем по размеру частиц следует, что коллоидные растворы (золи) занимают промежуточное положе-ние между молекулярными и грубодисперсными системами. Этим определяются два возможных пути получения коллоидных растворов. Один путь состоит в укрупнении частиц при агрегации молекул или ионов — такой метод называют конденсационным. Второй путь за-ключается в измельчении крупных частиц до коллоидной дисперс-ности, его осуществляют методом диспергирования.
Конденсация может протекать как химический и как физический процесс. И в том и в другом случае метод конденсации основан на образовании в гомогенной среде новой фазы, имеющей коллоид-ную дисперсность. Общим условием образования новой фазы явля-ется состояние пересыщения раствора или пара. При возникнове-нии местных пересыщений в каких-то участках раствора образуются агрегаты из нескольких молекул, которые и становятся зародышами новой фазы. Роль зародышей могут выполнять имеющиеся или вносимые в систему центры кристаллизации — пылинки, небольшие добавки готового золя и др. Чем больше число центров кристалли-зации и меньше скорость роста кристаллов, тем выше дисперсность получаемых золей.
Согласно современной теории образования в гомогенной среде зародышей новой фазы, этот процесс является флуктуационным. Условия образования зародышей твердой фазы выражает уравнение
где r — радиус кристалла; у — поверхностное натяжение на границе кристалл—раствор; Vm — молярный объем кристаллической фазы; с — концентрация насыщенного раствора; сr — концентрация пере-сыщенного раствора, необходимая для образования мелких кристал-лов с радиусом г.
Образование зародышей возможно при условии, когда сr> с. Из пересыщенного раствора может быть получена высокодисперс-ная система только в том случае, если скорость образования заро-дышей v намного больше, чем скорость их роста V2, т. е. Ј>i^>^2. В противном случае образуются крупные частицы, которые не обла-дают кинетической устойчивостью и выпадают в осадок.
В случае химической конденсации новая фаза возникает при протекании реакций, приводящих к образованию нерастворимых в данной среде веществ. Это могут быть реакции восстановления, окисления, обмена, гидролиза.
Для различных химических реакций, используемых при получе-нии золей, оптимальные условия образования и роста зародышей подбирают опытным путем. Как правило, высокодисперсные золи получают внесением в разбавленный раствор одного из реактивов небольшого количества концентрированного раствора второго реак-тива при интенсивном перемешивании. При такой методике обра-зовавшиеся зародыши твердой фазы быстро прекращают рост, так как разбавленный раствор скоро истощается. Свежеобразованная дисперсная фаза, состоящая из агрегатов нерастворимого вещества, часто имеет аморфное строение. С течением времени (от несколь-ких минут до суток) . идет процесс кристаллизации нерастворимых частиц и они приобретают кристаллическую структуру.
Реакции восстановления. Для получения золей благородных металлов (платины, золота, серебра) применяют обычно реакции восстановления. Восстановление может проводиться с применением защитных коллоидов или без них. В качестве защитных коллоидов используют ВМВ, которые адсорбируются на поверхности коллоид-ных частиц и образуют защитные пленки. В фармацевтической практике в присутствии защитных коллоидов получают препарат колларгол, представляющий собой коллоидный раствор серебра, защищенный солями лизальбиновой и протальбиновой кислот.
При получении золя золота золотохлористо-водородная кислота превращается в аурат калия по реакции
Реакция восстановления аурата калия формальдегидом протекает по уравнению
2КАuО2 + ЗНСНО + К2СО3 = 2Аu + ЗНСООК + КНСОз + Н2О
На образующихся микрокристаллах золота адсорбируются ионы аурата, являющиеся потенциалобразующими ионами. Противоионами служат ионы К + .
Методы гидролиза. Для получения золей гидроксидов тяжелых металлов применяют гидролиз.
Золь металлического серебра можно получить, восстанавливая разбавленные растворы солей серебра в щелочной среде танином. Танин (пентадигаллоилглюкоза) С76Н52О46, окисляясь, дает нераст-воримые вещества — флобафены С76Н52О49
📸 Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

25. Схема реакции и химическое уравнениеСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Коллоидные растворы. Дисперсные системыСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Реакции ионного обмена. 9 класс.Скачать

Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Получение коллоидных растворовСкачать

Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать