
С засором в трубах на кухне сталкивался каждый. Образоваться он может по техническим причинам, одной из которых является неправильный монтаж сантехники. В данном случае с проблемой могут справиться только специалисты, которые должны переустановить трубы.
Но чаще всего к сантехникам претензий нет, а засоры возникают по причине того, что в сливное отверстие мойки регулярно попадает жир, смываемый с тарелок и другой посуды. Оседая на стенках труб, он задерживает мелкие частицы, с потоком воды движущиеся мимо него. Постепенно их накапливается все больше. В результате образуется засор.
Многие рекомендуют ликвидировать его с помощью пищевой соды и уксусной кислоты. Я сама много лет пользовалась этим методом, не желая применять химические препараты. Каждый раз после такой прочистки труб я удивлялась, почему они так быстро снова засоряются.
Чтобы разобраться, пришлось заглянуть в справочники. Я вспомнила учителя химии. На уроках он демонстрировал нам много опытов с пищевой содой. Они всегда вызывали интерес, но я и предположить не могла, что когда-нибудь буду проводить их на собственной кухне. Хочу рассказать вам о ходе своих экспериментов.
- Сода пищевая
- Эксперимент
- Горячая вода
- Углекислый газ и давление в трубах
- Hlebinfo.ru – рецепты хлеба, оборудование для пекарни и дома
- Все от выпечки хлеба и кондитерских изделий до открытия мини пекарни – хлебопекарное оборудование, хлебопечка, сборник рецептов и рецептур, школа пекарей
- Технология производства
- Как гасить соду уксусом?
- Тогда зачем соду гасить уксусом?
- Чем заменить соду гашенную уксусом?
- Подведем итоги сказанному.
- Комментарии
- Гидрокарбонат натрия
- Содержание
- Химические свойства
- Реакция с кислотами
- Термическое разложение
- Получение
- Применение
- В химической промышленности
- В кулинарии
- В медицине
- Противопоказания к применению в медицинских целях
- Пожаротушение
- В быту
- В транспорте
- Производство
- Хранение
- Безопасность
- 💡 Видео
Видео:Опыт с уксусом и содойСкачать

Сода пищевая
Давайте вспомним, что представляет собой это вещество. Его формула выглядит так: NaHCO3. Это гидрокарбонат натрия, практически безвредный для здоровья. Более того, его применяют в медицине для лечения целого ряда заболеваний, таких как ларингит, ринит, фарингит, кашель. Раствор пищевой соды отлично дезинфицирует раны, помогает избавиться от изжоги и болей в желудке. Но при чем здесь засоры в трубах?
Оказывается, если гидрокарбонат натрия залить уксусом, происходит химическая реакция с образованием соли и угольной кислоты. Второе вещество крайне нестабильно. Оно почти сразу распадается на воду и углекислый газ. Именно его пузырьки мы видим при гашении соды любой кислотой. Считается, что углекислый газ может создавать большое давление, благодаря которому засор начинает проталкиваться по трубе. Гидрокарбонат натрия и уксус усиливают эффект, так как растворяют жир. Давайте это проверим.
Видео:СОДА И УКСУС?Скачать

Эксперимент
Для опыта возьмем два кусочка сливочного масла и поместим их в отдельные мисочки.
Этот продукт у нас будет играть роль жировых отложений в трубе. Далее в одной емкости смешаем полстакана гидрокарбоната натрия и 100 мл уксуса, а в другой – стакан очень горячей воды и столовую ложку жидкости для мытья тарелок. В итоге мы получим два препарата для прочистки труб.
Добавим их в миски с маслом. Что мы видим?
Масло, которое мы залили кипятком с моющим средством, начало таять. В соседней миске сода под воздействием уксусной кислоты вспенилась. Картина, которая наблюдалась через 5 минут, показана на фото ниже.
Вскоре масло под воздействием горячей воды и моющего средства превратилось в жирное пятно. Его можно легко удалить из миски, вылив ее содержимое.
Масло, залитое гидрокарбонатом натрия и уксусом, осталось в неизменном виде.
На фото ниже показано, что получилось в итоге. Как видим, масло, которое мы пытались убрать с помощью соды, никуда не исчезло.
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Горячая вода
Немного изменим ход эксперимента. На этот раз зальем масло не только раствором уксуса и гидрокарбоната натрия, но и очень горячей водой. Мы увидим, что жир мгновенно растворился. Вспомним уроки химии. На них учитель рассказывал, что под воздействием высокой температуры (более 60 °C) пищевая сода превращается в кальцинированную. При этом также образуются углекислый газ и вода.
Внешне кальцинированная сода практически ничем не отличается от пищевой, но это совсем другое вещество. Его формула выглядит так: Na2CO3. Кальцинированная сода (карбонат натрия) способна быстро растворять жиры и другие загрязнения. Ее добавляют в стиральные порошки, препараты для прочистки труб и очищения различных поверхностей. Карбонат натрия относят к 3 классу опасности. При попадании на слизистые и кожу он может вызвать дерматит.
Видео:Карбонат натрия из пищевой содыСкачать

Углекислый газ и давление в трубах
Сторонники использования пищевой соды говорят, что при добавлении к ней уксусной или любой другой кислоты образуется углекислый газ. Это совершенно верно. В школе нам демонстрировали опыт с бутылкой. В нее насыпали немного пищевой соды, наливали уксусную кислоту и затыкали пробкой. Образовавшийся СО2 эту пробку из бутылки выталкивал. Такой результат легко объяснить тем, что углекислому газу в герметически закрытой таре некуда деваться. Вот он и выталкивает пробку.
В трубе герметичности нет. Углекислый газ, образующийся при воздействии уксуса на гидрокарбонат натрия, спокойно выходит в отверстие мойки. Засор в трубе он не затрагивает.
Теперь вы убедились, что нет смысла использовать пищевую соду для прочистки труб. Устранить засор вам помогут химические препараты, выбор которых чрезвычайно широк.
К самым популярным можно отнести средства:
Если вы не желаете использовать химические препараты, регулярно промывайте трубы горячей водой с добавлением моющих средств. Если не получается справиться с засором такими методами, попробуйте воспользоваться вантузом или разберите и промойте сифон, расположенный под мойкой.
Видео:Эксперемент: химичиская реакция в взаимодействии уксусной кислоты и содыСкачать

Hlebinfo.ru – рецепты хлеба, оборудование для пекарни и дома
Видео:Реакция уксусной кислоты с карбонатом натрияСкачать

Все от выпечки хлеба и кондитерских изделий до открытия мини пекарни – хлебопекарное оборудование, хлебопечка, сборник рецептов и рецептур, школа пекарей
Технология производства
Видео:Реакция гидрокарбоната натрия и уксусной кислоты(сода+уксус). Химия от Оганнисяна.Скачать

Как гасить соду уксусом?
Пищевая сода гашеная уксусом, в современных рецептах приготовления кондитерского или блинного теста, очень часто рекомендуется в качестве разрыхлителя. Согласно рекомендациям, в тесто следует добавлять не уксус и соду (сами по себе), а продукт их взаимодействия – ацетат натрия, поскольку именно это вещество образуется в процессе гашения соды уксусом. Ацетат натрия (пищевая добавка Е262) в пищевом производстве используется в качестве консерванта или регулятора кислотности, но не в качестве разрыхлителя. Ацетат натрия обладает достаточно высокой термической устойчивостью и в условиях выпечки на газообразные продукты не разлагается, т.е. тесто он не разрыхляет!
Видео:Реакция уксусной кислоты и гидрокарбоната натрияСкачать

Тогда зачем соду гасить уксусом?
Попробуем разобраться в этом вопросе более внимательно (с точки зрения профессионального химика). Кстати обратите внимание на статью пищевая сода в дрожжевом тесте. А пока продолжим.
В 1 средней чайной ложке без горки помещается 8 г пищевой соды. Если налить в эту чайную ложку (до краев!) уксус (9% растовор уксусной кислоты) или уксусную эссенцию (70% раствор уксусной кислоты), то их масса составит примерно 4 г. Таким образом, для того чтобы полностью погасить 1 чайную ложку пищевой соды уксусной кислотой, потребуется примерно 71 г (16 чайных ложек) уксуса (9%) или 8 г (2 чайные ложки) уксусной эссенции (70%).
Цитирую рекомендации, приведенные на популярных кулинарных форумах, по теме как правильно гасить соду уксусом:
— «в ложку зачерпните соду и капните туда уксус, сода зашипит, я немного перемешиваю ее. Все! Сода погашена!»;
— «на 1 чайную ложку добавьте 4-6 капель 9% уксуса»;
— «как гасить соду уксусом: смешайте 1 ложку соды с 1 ложкой уксуса»;
— в самом смелом совете рекомендуется «к ½ ч.л. питьевой соды прибавить 1 десертную ложку уксуса». В 1 десертной ложке помещается 2 чайные, т.е. в этом совете рекомендуется для гашения 1 чайной ложки соды использовать только 4 чайные ложки уксуса, а не 16, как требуется по расчету.
Вывод очевиден – тесто разрыхляет та пищевая сода, которая остается после завершения эффектного опыта по ее гашению уксусом. При нагревании теста пищевая сода разлагается с выделением углекислого газа, который и придает тесту определенную пористость.
Весь смысл предварительного гашения соды уксусом заключается в том, что кулинар получает возможность полюбоваться на впечатляющие результаты химического опыта, в ходе которого получается «шипучка».
Обратите внимание на то, что при термическом разложении пищевой соды (гидрокарбоната натрия) в тесте остается карбонат натрия (Na2CO3). Это вещество называется кальцинированная сода или просто сода, в быту ее используют для стирки белья или для обработки смородины от мучнистой росы.
Кулинары (забывшие химию) утверждают, что при гашении соды уксусом в готовой выпечке уменьшается неприятный привкус соды. Это в какой-то степени правильно, поскольку в результате реакции гашения содержание соды в готовом продукте несколько уменьшается. Однако привкус соды будет оставаться до тех пор, пока весь карбонат натрия не будет разрушен кислотами, содержащимися в продуктах, используемых для замеса теста. Если таковых кислот нет или их мало, привкус соды останется.
Реакция сода и уксус имеет вид следующего уравнения
Сода и уксус химическая реакция
Если химическая реакция уксус + сода пройдет полностью, то в тесте не останется соды, которая придает готовому изделию неприятный «мыльный» привкус.
Для того чтобы тесто было хорошо разрыхлено и не имело выраженного привкуса соды, необходимо вносить кислоту и соду в тесто в правильной последовательности и в нужной пропорции.
Видео:Взаимодействие уксусной кислоты с металламиСкачать

Чем заменить соду гашенную уксусом?
Вместо уксусной кислоты для нейтрализации соды в тесте можно использовать любую пищевую кислоту (молочную, лимонную, яблочную, виннокаменную и др.) или кислые соли, разрешенные для применения в пищевом производстве.
Очень удобна в этом отношении лимонная кислота (пищевая добавка Е330). Лимонная кислота не имеет резкого запаха и поступает в продажу в кристаллическом состоянии (в форме моногидрата, в котором на 1 молекулу кислоты приходится 1 молекула воды: С6Н8О7∙Н2О).
Для того, чтобы полностью «погасить» 8 г (1 чайную ложку) пищевой соды, требуется 6,7 г (1,5 чайные ложки) кристаллической лимонной кислоты.
Приведу рецепт приготовления скороспелых блинов, опубликованный более 100 лет тому назад (1901 г).
Обратите внимание на то, что на 2,7 кг теста в этом рецепте рекомендуется использовать только 1 чайную ложечку соды, для нейтрализации которой используется 1 чайная ложка лимонной кислоты. Кислота и сода растворяются в воде по отдельности в разных стаканах! В тесто сначала вносится раствор кислоты, размешивается и только потом вносится раствор соды. При такой последовательности внесения ингредиентов, реакция между кислотой и содой протекает непосредственно в тесте. Углекислый газ быстро и равномерно разрыхляет весь объем теста, а не развлекает хозяйку бессмысленным шипением и «пузырением» в чайной ложке.
При рекомендуемом в рецепте соотношении лимонной кислоты и пищевой соды реакция разложения пищевой соды протекает достаточно полно, но не до конца. Часть соды остается непогашенной. Это очень важное условие для хорошего разрыхления теста. Выделяющийся при взаимодействии лимонной кислоты и пищевой соды углекислый газ разрыхляет блинное тесто в процессе его приготовления. Оставшаяся в избытке пищевая сода разлагается в процессе выпечки блинов и придает им дополнительную пористость.
Удивительно, но наши пра-прабабушки знали химию гораздо лучше нас и умели правильно и вполне осмысленно ей пользоваться.
Подведем итоги сказанному.
Гашение соды уксусом перед внесением их в тесто не имеет кулинарного смысла, поскольку выделяющийся в ходе этой реакции углекислый газ попадает не в тесто, а уходит в воздух. Тесто при этом необоснованно загрязняется ацетатом натрия. Для нормального разрыхления теста реакция разложения соды с выделением углекислого газа должна протекать непосредственно в тесте, причем сода должна быть равномерно распределена по всему его объему.
Фото к комментариям присылайте на hlebinfo@mail.ru
Для предотвращения спама, комментарии публикуются после проверки модератором.
Пока ждете ответа на комментарий, можете посмотреть рекламу!
Видео:Пищевая сода опасна! (русская озвучка)Скачать

Комментарии
Вот это да! Дебаты по поводу соды+уксуса не утихают седьмой год! Подброшу ка еще вопросик…. А если я использую в тесте кефир или сыворотку? КАк в этом случае добавлять соду и нужна ли она там вообще? В расчете на стакан км жидкости? Я просто на глаз сыплю,пол чайной ложки,но результат не всегда нравится. И да ,это не блины на выходе,а пирог с яблоками или ягодами…
Кефир и сыворотка являются источниками органических кислот, т.е. это аналоги уксусной кислоты. Однако, Вы не знаете, сколько кислот накопил Ваш кефир или сыворотка. Это «живые» продукты, в которых лихо работают молочнокислые бактерии. рН-метр в этом случае не поможет, т.к. он измеряет активную кислотность, а для определения общей кислотности применяют метод титрования. Пока бегаете в лабораторию — кислотность кефира и сыворотки изменится. Поэтому сода в тесто на кефире или сыворотке добавляется «наудачу»…
Блины на кефире можно печь и с содой и без соды. Как Вам нравится. До середины XIX века соду в кулинарии вообще не использовали. Если печете пирог на кефире, то количество добавляемой соды более критично: мало соды — тесто получится тяжелым, много соды — появится неприятный «содистый» привкус. Удачи!
Подскажите мне нужно сделать тесто на пахлову и туда идёт сода,но не хочу гасить уксусом,сколько положить лим.кислоты и как гасить,из расчета на 3 кг муки.?подскажите?)))
Уважаемая Светлана! У нас нет рецепта теста для пахлавы с лимонной кислотой.
Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

Гидрокарбонат натрия
| Гидрокарбонат натрия | |
|---|---|
 | |
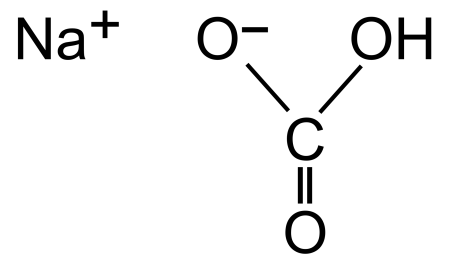 | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрокарбонат натрия (лат. Natrii hydrocarbonas ), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Видео:Вторая реакция уксусной кислоты, на соду, вместе с водой ,и моющие.Скачать

Содержание
- 1 Химические свойства
- 1.1 Реакция с кислотами
- 2 Термическое разложение
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В кулинарии
- 4.3 В медицине
- 4.3.1 Противопоказания к применению в медицинских целях
- 4.4 Пожаротушение
- 4.5 В быту
- 4.6 В транспорте
- 5 Производство
- 6 Хранение
- 7 Безопасность
Видео:Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
Видео:Что будет, если пить соду по утрам каждый день?Скачать

Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Видео:Химическая реакция. Сода + уксусная кислота.Скачать

Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
Видео:Очистите печень БЕЗ ТАБЛЕТОК И ВРАЧЕЙ! Продукты восстанавливающие печеньСкачать

Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl — , в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Видео:Na2CO3 + CH3COOH | сода + уксусная кислота | В домашних условияхСкачать

Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Видео:Эксперимент с уксусом и содой.Скачать

Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Видео:Сода + уксусная кислотаСкачать

Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м 3 .
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
💡 Видео
Смешал Уксус с Содой, такого Эффекта я не ожидал! Вот что Творит Сода с Уксусом...Скачать














