- Углерод. Химия углерода и его соединений
- Углерод
- Положение в периодической системе химических элементов
- Электронное строение углерода
- Физические свойства
- Качественные реакции
- Соединения углерода
- Химические свойства
- Карбиды
- Оксид углерода (II)
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Оксид углерода (IV)
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Карбонаты и гидрокарбонаты
- Гидролиз карбонатов и гидрокарбонатов
- Напишите уравнения реакций : а) оксида серы (4) с гидроксидом калия, б) оксида углерода (4) с гидроксидом бария, в) оксида кремния (4) с гидроксидом натрия?
- Напишите уравнения реакций соединения с водой следующих оксидов : оксид натрия, оксида серы ( 4), оксида бария, оксида фосфора ( 5)?
- Напишите уравнения возможных реакций :1)гидроксид кальция + оксид лития2)гидроксид бария + оксид фосфора (V)3)гидроксид калия + оксид алюминия4)гидроксид натрия + сульфат бария?
- Составьте уравнение реакции — гидроксид бария и оксид кремния?
- С какими из перечисленных веществ гидроксид натрия, оксид натрия, оксид серы, серная кислота, сульфат натрия — реагирует с оксидом алюминия и гидроксид алюминия?
- 1. С какими из перечисленных веществ будет взаимодействовать ОКСИД УГЛЕРОДА (IV) : серная кислота, вода, хлорид железа (III), гидроксид натрия, гидроксид меди, оксид калия, оксид азота (II), оксид сер?
- Какими из перечисленных веществ будет взаимодействовать ОКСИД КАЛИЯ :серная кислота, вода, хлорид железа (III), гидроксид натрия, гидроксид меди, оксид калия, оксид азота (II), оксид серы (IV)?
- С какими из перечисленных веществ будет взаимодействовать ОКСИД УГЛЕРОДА (4) : серная кислота, вода, хлорид железа (3) , гидроксид натрия, гидроксид меди, оксид калия, оксид азота (2), оксид серы (4)?
- С какими из перечисленных веществ будет взаимодействовать ОКСИД КАЛИЯ : серная кислота, вода, хлорид железа (3) , гидроксид натрия, гидроксид меди, оксид калия, оксид азота (2), оксид серы (4)?
- Напишите взаимодействие оксида серы (IV) с водой, гидроксидом натрия, оксидом натрия?
- Напишите уравнения реакции между веществами :вольфрамат калия + соляная кислотагидроксид железа(2) + соляная кислотаоксид кремния(4) + гидроксид натрия?
- 🔍 Видео
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 2 :
- C — 2s 2 2p 2
- Si — 3s 2 3p 2
- Ge — 4s 2 4p 2
- Sn — 5s 2 5p 2
- Pb — 6s 2 6p 2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
Химические свойства
- Реакции с неметаллами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
Реакции с металлами
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
Реакции с кислотами
В реакциях с кислотами углерод проявляет себя как восстановитель:
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:
- Реакция с водой
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
Реакции с основными оксидами и основаниями
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха.
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
Нагревание солей угольной кислоты
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Углерод. Химия углерода и его соединений
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии :
+6С 1s 2 2s 2 2p 2 1s 

Электронная конфигурация углерода в возбужденном состоянии :
+6С * 1s 2 2s 1 2p 3 1s 

Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp 3 -гибридизации.
Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp 2 -гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO3 2- — взаимодействие солей-карбонатов с сильными кислотами . Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например , карбонат кальция растворяется в соляной кислоте:
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2 не поддерживает горение . Угарный газ CO горит голубым пламенем.
Соединения углерода
Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО муравьиная кислота HCOOH |
| -4 | метан CH4 карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами , и с неметаллами .
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором .
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
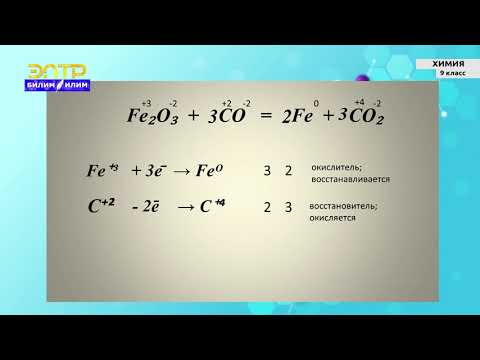
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов . При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например , углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например , углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями , в которых содержатся неметаллы с высокой степенью окисления.
Например , углерод восстанавливает сульфат натрия до сульфида натрия:
Карбиды
Карбиды – это соединения элементов с углеродом . Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами Например : SiC, B4C | Это соединения с металлами, в которых с.о. углерода равна -4 Например : Al4C3, Be2C | Это соединения с металлами, в которых с.о. углерода равна -1 Например : Na2C2, CaC2 | |
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли: Например : Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 | Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли: Например: СаС2+ 2Н2O → Са(OH)2 + С2Н2 | |