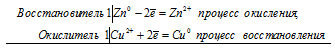- Решение задач по химии на коррозию металлов
- а) Электрохимические процессы при реакции цинка и сульфата меди
- б) Электрохимические процессы при реакции железа и сульфата меди
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Опыт 2 образование микрогальванопар
- 📸 Видео
Видео:Химическая реакция цинка и медного купоросаСкачать

Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Видео:Реакция цинка с соляной кислотой. Химический опытСкачать

Please wait.
Видео:Реакция медного купороса и цинкаСкачать

We are checking your browser. gomolog.ru
Видео:Взаимодействие железа с сульфатом медиСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химический опыт Взаимодействия медного купороса и железаСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de2cbace8e3978e • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Опыт 2 образование микрогальванопар
Ход опыта: В пробирку с раствором серной кислоты помещаем гранулу Zn. Приливаем несколько капель р-ра CuSO4. Наблюдаем за процессами, идущими в пробирке.
Данные опыта: До добавления в пробирку раствора медного купороса реакция шла медленно. После того, как добавили CuSO4, наблюдается выделение меди на цинке и очень интенсивное выделение газообразного водорода.
Расчёт и анализ экспериментальных данных:
Zn + H2SO4 = ZnSO4 + H2 (1)
CuSO4 + Zn = ZnSO4 + Cu (2)
Cu2+ + Zn = Zn2+ + Cu
K: 2H3O+ + 2e = H2 + 2H2O
Zn + 2H3O+ = Zn2+ + H2 + 2H2O
Zn +H2SO4 = ZnSO4 + H2
Вывод: До добавления CuSO4 в системе идет процесс, описываемый уравнением (1). После добавления в реакционное пространство раствора медного купороса начинают идти процессы, описываемые уравнениями (2): Цинк вытесняет медь из ее соли, после чего возникает короткозамкнутый гальванический элемент, в котором цинк служит анодом и растворяется, а медь служит катодом, и на ней происходит восстановление ионов гидроксония с образованием воды и газообразного водорода.
📸 Видео
Качественная реакция ионов цинка со щелочью. Получение и свойства гидроксида цинкаСкачать

Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Электролиз раствора медного купороса, домашняя лаборатория, получение чистой медиСкачать

Разложение медного купороса. Химический опытСкачать

Лабораторный опыт N9 "Взаимодействие цинка с разбавленной соляной кислотой"Скачать

Медный купорос и аммиак. Химический опыт. Точка Гравитации.Скачать

Реакция Цинка и СерыСкачать

Взаимодействие металлов с солямиСкачать

Взаимодействие хлорида олова с цинкомСкачать

ВЗАИМОДЕЙСТВИЕ ЖЕЛЕЗА С РАСТВОРОМ МЕДНОГО КУПОРОСА. ПРАКТИЧЕСКИЕ ОПЫТЫ ПО ХИМИИСкачать

Хлопушка дьявола - реакция серы и цинка!Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

ЭлектролизСкачать

Реакция сойденения медного купороса(CuSO4) и соды(Na2CO3).Скачать