Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
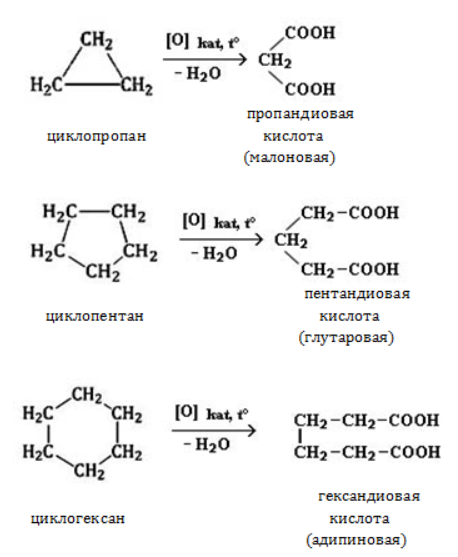
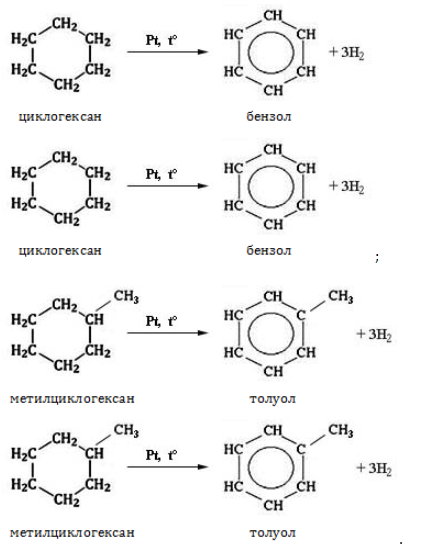
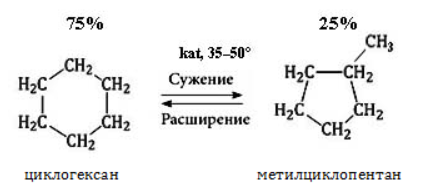
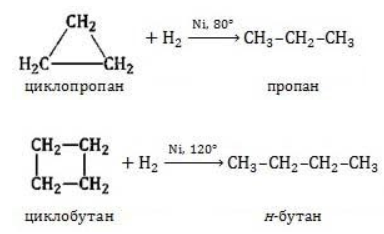
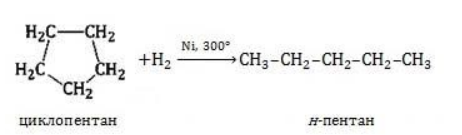
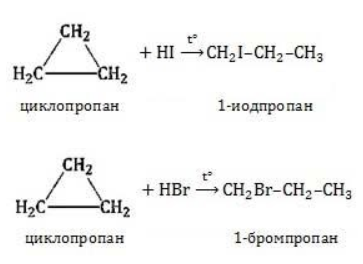
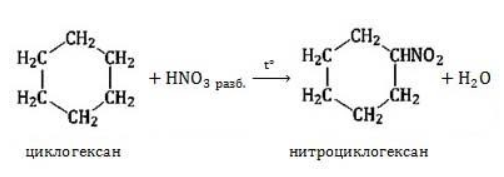
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать  Взаимодействие циклопропана с водородом?Химия | 10 — 11 классы Взаимодействие циклопропана с водородом. Циклопропан реагирует с водородом (в присутствии платинового катализатора) с образованием пропана. Углерод — углеродная связь в циклопропане при этой реакции разрывается. СН2 Ho / Pt / —СН3 — СНа — СН2 Н2С—СН2. Видео:Водород/химические свойства водорода/8 классСкачать  С какими веществами не взаимодействует водород?С какими веществами не взаимодействует водород? Видео:Химические свойства циклоалканов. Малые циклы: циклопропан и циклобутан.Скачать  В промышленности водород получают взаимодействием?В промышленности водород получают взаимодействием. Видео:Уравнивание реакций горения углеводородовСкачать  Как написать формулу циклопропана?Как написать формулу циклопропана? Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Взаимодействие триолеин глицерина с водородом?Взаимодействие триолеин глицерина с водородом. Видео:5.1. Циклоалканы: Строение, изомерия. ЕГЭ по химииСкачать  При взаимодействии циклопропана с бромом образуется 1, 3 — дибромпропан?При взаимодействии циклопропана с бромом образуется 1, 3 — дибромпропан. Рассчитайте, какую массу 1, 3 — дибромпропана можно получить при бромировании 84г циклопропана, если выход продукта составляет 85% (C3H6 + Br2 — > ; C3H6Br2). Видео:Водород. 8 класс.Скачать  Как можно получить циклопропан?Как можно получить циклопропан. Видео:5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать  CuO взаимодействует ли с водородом?CuO взаимодействует ли с водородом? Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Формула взаимодействия этаналя с водородом?Формула взаимодействия этаналя с водородом. Видео:Всё о циклоалканах за 40 минут | Химия 10 класс | УмскулСкачать  Какой объем водорода (н?Какой объем водорода (н. У. ) потребуется для гидрирования 15, 75г циклопропана? Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Молекулярная масса циклопропана?Молекулярная масса циклопропана. На этой странице находится вопрос Взаимодействие циклопропана с водородом?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 10 — 11 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку. N(hcl) = 112 / 22. 4 = 5моль n = m / M m = n * M m = 36, 5 * 5 = 182, 5г. Надеюсь правильно. Примного извиняюсь за ошибки(シ_ _)シ. Ответ смотри в фотографии. Вот, только в последней реакции есть сомнения насчёт того, как уравнять : скореесли всего, не надо ставить ппред остром цинка двойку. Углеводород метан СН4. ПР(MgCO3) = [Mg2 + ][CO3 2 — ] = 10 ^ — 5 [Mg2 + ] = корень из 10 ^ — 5 [Mg2 + ] = 3. 2 * 10 ^ — 3 моль / л = 3. 2 ммоль / л M(Mg) = 24 г / моль С(Mg) = 3. 2 * 10 ^ — 3 * 24 = 0. 0768 г / л. 1. С14Н29ОН 2. СН3ОН 3. С2Н6О2. В периоде справа налево неметаллические свойства усиливаются, слева направо уменьшаются В главных подгруппах неметаллические свойства сверху вниз ослабевают. Поэтому ответ 2. CaO + CO2⇒CaCO3 — образуется карбонат кальция. Степень окисления простых веществ = 0 Cl0 Степень окисления металлов положительна определяется валентностью Zn( + 2)O Степень окисления О = — 2, кроме соединения с F и в перекисях H2( + 1)O2( — 1) Степень окисления Н = + 1, кроме соединения с металла.. Видео:Свойства и применение водорода. 8 класс.Скачать  Химические свойства циклоалкановКоличество углеродных атомов в цикле, образующем молекулу, влияет на свойства циклоалканов, проявляемые в различных видах химических взаимодействий. Соединения с малыми циклами, в которых существенную роль играет угловое напряжение, отличаются неустойчивостью и близки по свойствам к непредельным углеводородам. Чем больше звеньев в цикле, тем сильнее проявляются свойства, присущие алканам. Видео:Органическая химия Углеводород Пропан Циклопропан Дегидрирование Гидрирование 10 класс ЕГЭ ВидеоурокСкачать  Реакции присоединенияУчастие в процессах этого типа, связанных с разрывом замкнутого участка молекулы, свойственно циклопропану ГидрированиеУсловиями реакции являются нагревание и присутствие катализатора. Цикл размыкается с образованием алкана: Для вступления в реакцию циклопентана требуются более жесткие условия: Это единственная реакция присоединения, в которую способен вступать циклопентан. Сходство химических свойств циклоалканов с более высоким углеродным числом обусловливает их неучастие в реакциях присоединения. ГалогенированиеПродуктом этой реакции становится дигалогеналкан: ГидрогалогенированиеЦиклопропан реагирует в водном растворе с галогенводородами: Присоединять галогенводород способны и гомологи циклопропана с углеводородным радикалом и трехчленным циклом. В процессах гидрогалогенирования циклоалканов соблюдается правило Марковникова, согласно которому водород присоединяется к максимально гидрогенизированному атому углерода: Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Реакции замещенияДля циклоалканов со слабо напряженным или ненапряженным циклом ( ГалогенированиеВ результате реакции образуется галогенциклоалкан: Хлорирование малого цикла также может происходить без его разрыва, если температура реакции не превысит 100° C: НитрованиеАзотная кислота должна быть разбавленной. Продукт взаимодействия – нитроциклоалкан: Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать  Окисление циклоалкановРеакции окисления одинаково свойственны всем циклоалканам. Аналогично предельным незамкнутым углеводородам, они не реагируют с водным раствором Мягкое окислениеПри мягком окислении воздухом на хлориде кобальта получают алициклические кислородсодержащие соединения (кетон и спирт): Жесткое окислениеС использованием катализатора воздействие сильного окислителя (например, разбавленной азотной кислоты) на циклоалкан приводит к образованию двухосновных кислот. Реакция протекает в жестких условиях: Полное окисление (горение)В общем виде уравнение горения циклоалканов записывается: Инициирует реакцию контакт с открытым пламенем. Видео:Какие вещества образуются при взаимодействии циклопропана с бромом, бромоводородом и водородом?Скачать  Реакция отщепленияНагревание в присутствии металлического катализатора приводит к дегидрированию циклоалканов – отщеплению водорода и образованию ароматического соединения бензольного ряда: Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  ИзомеризацияЦиклоалканы способны изомеризоваться с перегруппировкой атомов в углеродном скелете. Процесс протекает на платине, хлориде или бромиде алюминия и сопровождается сужением либо расширением цикла. Образование средних циклов происходит легче, и они отличаются большей устойчивостью: Реакция идет в обоих направлениях до установления равновесия. Для низших циклоалканов предпочтительной оказывается изомеризация с расширением цикла, так как она ведет к ослаблению углового напряжения в молекуле. Так, метилциклобутан переходит в циклопентан необратимо: Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать  ЗаключениеЦиклоалканы, находящиеся в начале гомологического ряда, сочетают в своих химических взаимодействиях свойства предельных и непредельных углеводородов линейного строения. Комбинация свойств вызвана, с одной стороны, особыми условиями образования непрочных изогнутых связей в простейших циклах, и, с другой стороны, насыщенностью соединений. Высшие циклоалканы практически не отличаются по химическим свойствам от алканов, так как их макроциклы не оказывают деформирующего влияния на строение химических связей. 📸 ВидеоКак решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Физические и химические свойства водорода Применение водородаСкачать  |











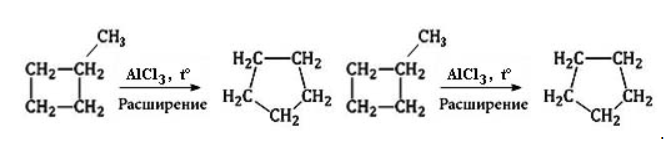
 и циклобутану
и циклобутану 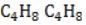 , обладающим малыми циклами.
, обладающим малыми циклами.


 ) характерно замещение водорода без разрушения цикла.
) характерно замещение водорода без разрушения цикла.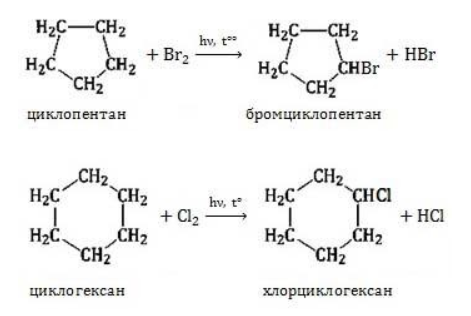
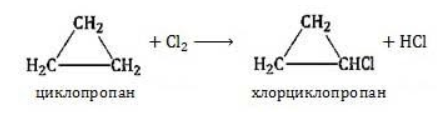
 , но подвергаются каталитическому окислению и горят, как все углеводороды.
, но подвергаются каталитическому окислению и горят, как все углеводороды.