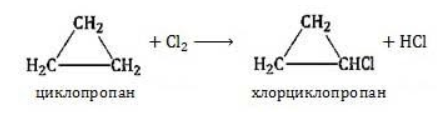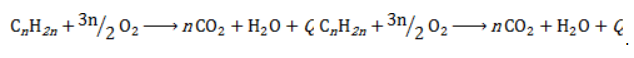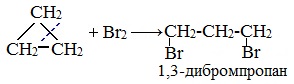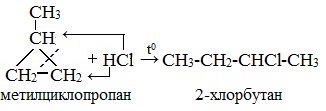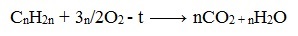Количество углеродных атомов в цикле, образующем молекулу, влияет на свойства циклоалканов, проявляемые в различных видах химических взаимодействий. Соединения с малыми циклами, в которых существенную роль играет угловое напряжение, отличаются неустойчивостью и близки по свойствам к непредельным углеводородам. Чем больше звеньев в цикле, тем сильнее проявляются свойства, присущие алканам.
- Реакции присоединения
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Реакции замещения
- Галогенирование
- Нитрование
- Окисление циклоалканов
- Мягкое окисление
- Жесткое окисление
- Полное окисление (горение)
- Реакция отщепления
- Изомеризация
- Заключение
- Циклоалканы
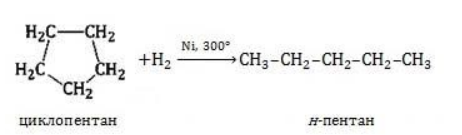
- Уравнение реакции циклопентана с водородом
- Реакции присоединения (малые циклы (n=3,4)) — сходство с алкенами
- Реакции замещения (обычные циклы (n=5-7)) – сходство с алканами
- Реакции окисления
- 🎬 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции присоединения
Участие в процессах этого типа, связанных с разрывом замкнутого участка молекулы, свойственно циклопропану 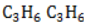
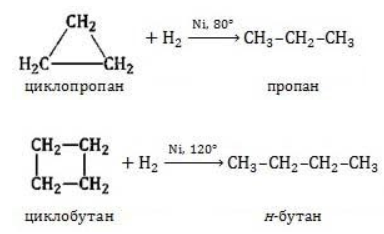
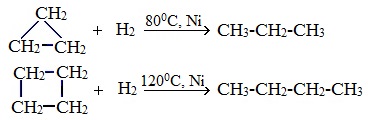
Гидрирование
Условиями реакции являются нагревание и присутствие катализатора. Цикл размыкается с образованием алкана:
Для вступления в реакцию циклопентана требуются более жесткие условия:
Это единственная реакция присоединения, в которую способен вступать циклопентан. Сходство химических свойств циклоалканов с более высоким углеродным числом обусловливает их неучастие в реакциях присоединения.
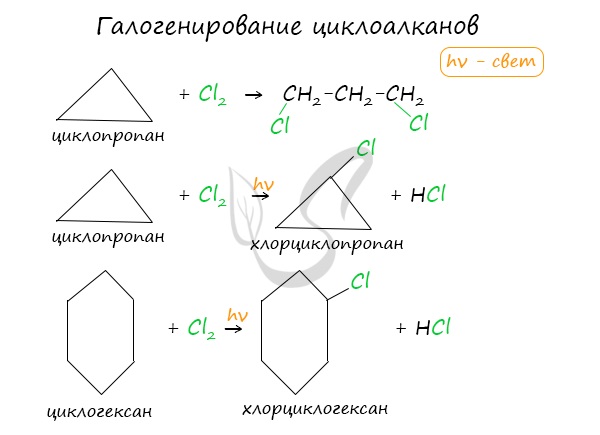
Галогенирование
Продуктом этой реакции становится дигалогеналкан:
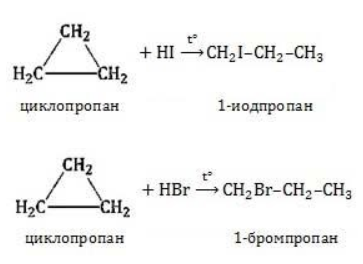
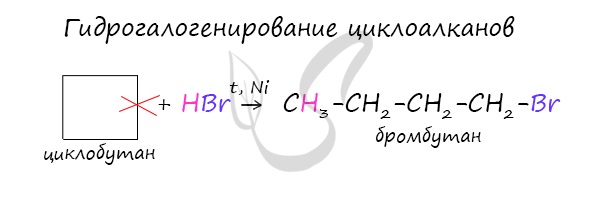
Гидрогалогенирование
Циклопропан реагирует в водном растворе с галогенводородами:
Присоединять галогенводород способны и гомологи циклопропана с углеводородным радикалом и трехчленным циклом. В процессах гидрогалогенирования циклоалканов соблюдается правило Марковникова, согласно которому водород присоединяется к максимально гидрогенизированному атому углерода:
Видео:Водород/химические свойства водорода/8 классСкачать

Реакции замещения
Для циклоалканов со слабо напряженным или ненапряженным циклом (
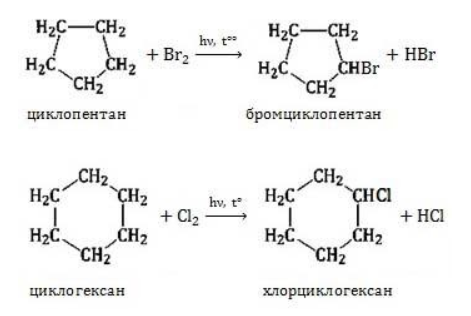
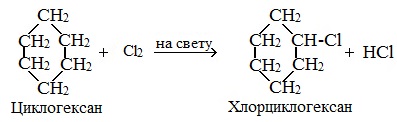
Галогенирование
В результате реакции образуется галогенциклоалкан:
Хлорирование малого цикла также может происходить без его разрыва, если температура реакции не превысит 100° C:
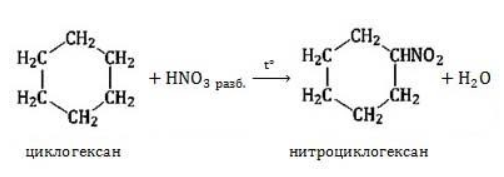
Нитрование
Азотная кислота должна быть разбавленной. Продукт взаимодействия – нитроциклоалкан:
Видео:Водород. 8 класс.Скачать

Окисление циклоалканов
Реакции окисления одинаково свойственны всем циклоалканам. Аналогично предельным незамкнутым углеводородам, они не реагируют с водным раствором 
Мягкое окисление
При мягком окислении воздухом на хлориде кобальта получают алициклические кислородсодержащие соединения (кетон и спирт):
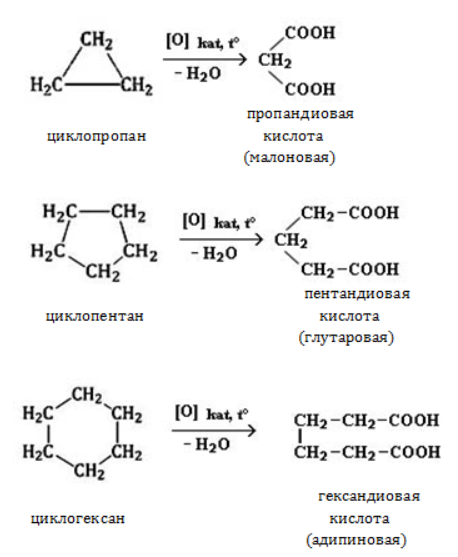
Жесткое окисление
С использованием катализатора воздействие сильного окислителя (например, разбавленной азотной кислоты) на циклоалкан приводит к образованию двухосновных кислот. Реакция протекает в жестких условиях:
Полное окисление (горение)
В общем виде уравнение горения циклоалканов записывается:
Инициирует реакцию контакт с открытым пламенем.
Видео:Химия 8 класс (Урок№13 - Водород: нахождение в природе, получение, его физ. и хим. свойства.)Скачать

Реакция отщепления
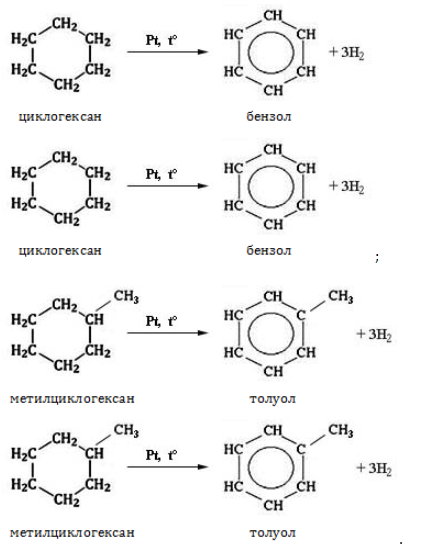
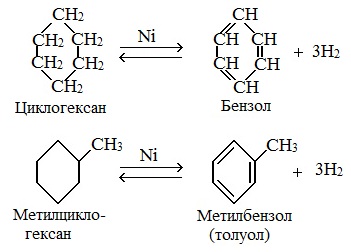
Нагревание в присутствии металлического катализатора приводит к дегидрированию циклоалканов – отщеплению водорода и образованию ароматического соединения бензольного ряда:
Видео:5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать

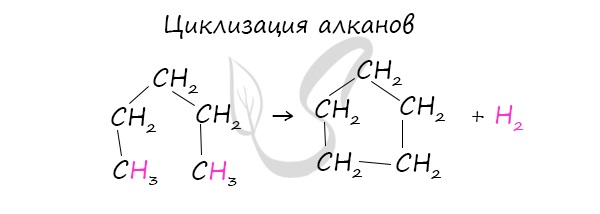
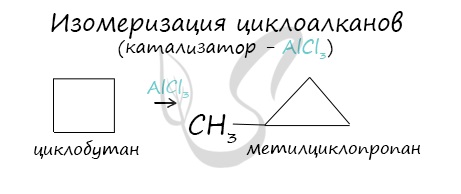
Изомеризация
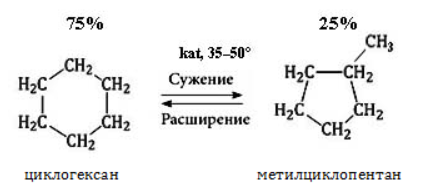
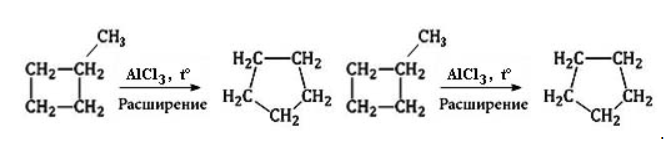
Циклоалканы способны изомеризоваться с перегруппировкой атомов в углеродном скелете. Процесс протекает на платине, хлориде или бромиде алюминия и сопровождается сужением либо расширением цикла. Образование средних циклов происходит легче, и они отличаются большей устойчивостью:
Реакция идет в обоих направлениях до установления равновесия.
Для низших циклоалканов предпочтительной оказывается изомеризация с расширением цикла, так как она ведет к ослаблению углового напряжения в молекуле. Так, метилциклобутан переходит в циклопентан необратимо:
Видео:Уравнивание реакций горения углеводородовСкачать

Заключение
Циклоалканы, находящиеся в начале гомологического ряда, сочетают в своих химических взаимодействиях свойства предельных и непредельных углеводородов линейного строения. Комбинация свойств вызвана, с одной стороны, особыми условиями образования непрочных изогнутых связей в простейших циклах, и, с другой стороны, насыщенностью соединений.
Высшие циклоалканы практически не отличаются по химическим свойствам от алканов, так как их макроциклы не оказывают деформирующего влияния на строение химических связей.
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Циклоалканы
Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда — CnH2n.
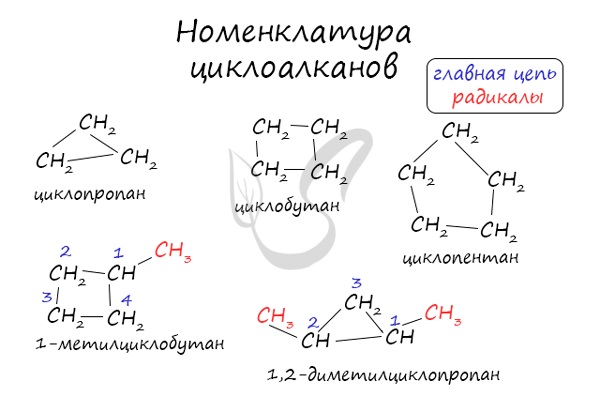
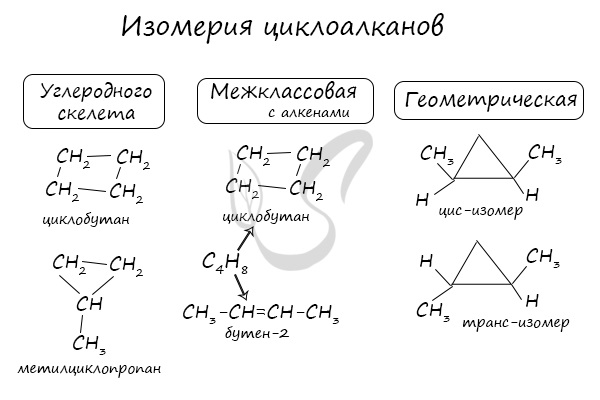
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Свойства и применение водорода. 8 класс.Скачать

Уравнение реакции циклопентана с водородом
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость.
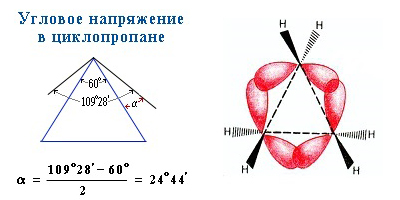
Трех- и четырехчленные циклы (малые циклы), являются насыщенными, но, несмотря на это резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp 3 -гибридизованному атому углерода.
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
В циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
Реакции присоединения (малые циклы (n=3,4)) — сходство с алкенами
1. Гидрирование
Циклопропан, циклобутан довольно легко присоединяют водород, образуя соответствующие нормальные алканы.
2. Галогенирование
Малые циклы (С3 — С4) способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном). С алкенами реакция идет при комнатной температуре, для циклоалканов необходимо нагревание.
3. Гидрогалогенирование
В реакцию присоединения с галогеноводородами опять де вступают только малые циклы при нагревании.
Присоединение к гомологам циклопропана происходит по правилу Марковникова.
Реакции замещения (обычные циклы (n=5-7)) – сходство с алканами
1. Галогенирование
2. Нитрование

Реакции отщепления (обычные циклы (n=5-7)) – сходство с алканами
1. Дегидрирование
Эти соединения, подобно алканам, вступают в реакции дегидрирования.
Дегидрирования циклогексана (реакция Зелинского-Казанского) и его алкильных производных.
Реакции окисления
1. Реакция горения
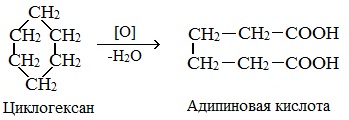
2. Окисление в присутствии катализатора.
При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота.
Сравнение свойств
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла.
Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
🎬 Видео
ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Урок 7. Циклоалканы (химические свойства)Скачать

ЦИКЛОАЛКАНЫСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

38. Водород. Химические свойстваСкачать

5.1. Циклоалканы: Строение, изомерия. ЕГЭ по химииСкачать

Взаимодействие хлора с водородомСкачать

Химические свойства циклоалкановСкачать

Всё о циклоалканах за 40 минут | Химия 10 класс | УмскулСкачать

Органическая химия с нуля | Химия ЕГЭ 2023 | УмскулСкачать

Галогены. 9 класс.Скачать

25. Схема реакции и химическое уравнениеСкачать