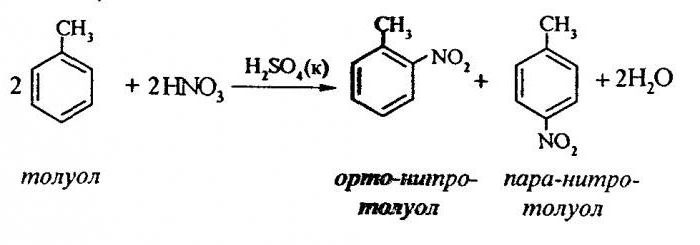
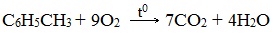Поговорим о том, как осуществляется нитрование толуола. Получают подобным взаимодействием огромное количество полуфабрикатов, используемых в изготовлении взрывчатых веществ, фармацевтических препаратов.
Видео:Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Значимость нитрования
Производные бензола в виде ароматических нитросоединений выпускаются в современной химической промышленности. Нитробензол является полупродуктом в анилинокрасочном, парфюмерном, фармацевтическом производстве. Он является отличным растворителем для многих органических соединений, включая и нитрит целлюлозы, формируя с ним желатинообразную массу. В нефтяной промышленности его применяют в качестве очистителя для смазочных масел. При нитровании толуола получают бензидин, анилин, аминосалициловую кислоту, фенилендиамин.
Видео:Нитрование бензолаСкачать

Характеристика нитрования
Нитрование характеризуется вводом группы NO2 в молекулу органического соединения. В зависимости от исходного вещества протекает данный процесс по радикальному, нуклеофильному, электрофильному механизму. В качестве активных частиц выступают катионы нитрония, ионы и радикалы NO2. Реакция нитрования толуола относится к замещению. Для других органических веществ возможно заместительное нитрование, а также присоединение по двойной связи.
Нитрование толуола в молекуле ароматического углеводорода осуществляется с помощью нитрующей смеси (серной и азотной кислот). Каталитические свойства проявляет серная кислота, выступающая в данном процессе в качестве водотнимающего средства.
Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Уравнение процесса
Нитрование толуола предполагает замещение одного водородного атома нитрогруппой. Как выглядит схема протекающего процесса?
Для того чтобы описать нитрование толуола, уравнение реакции можно представить в следующем виде:
ArH + HONO2+ = Ar-NO2 +H2 O
Оно позволяет судить только об общем ходе взаимодействия, но не раскрывает всех особенностей данного процесса. На самом деле происходит реакция между ароматическими углеводородами и продуктами азотной кислоты.
Учитывая, что в продуктах есть молекулы воды, это приводит к снижению концентрации азотной кислоты, поэтому нитрование толуола замедляется. Для того чтобы избежать подобной проблемы, осуществляют данный процесс при невысоких температурах, используя азотную кислоту в избыточном количестве.
Помимо серной кислоты, в качестве водоотнимающих средств применяют уксусный ангидрид, полифосфорные кислоты, трехфтористый бор. Они дают возможность снизать расход азотной кислоты, повышают эффективность взаимодействия.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Нюансы процесса
Нитрование толуола было описано в конце девятнадцатого века В. Марковниковым. Ему удалось установить связь между присутствием в реакционной смеси концентрированной серной кислоты и скоростью протекания процесса. В современном производстве нитротолуола применяют безводную азотную кислоту, взятую в некотором избытке.
Кроме того, сульфирование и нитрование толуола связано с использованием доступного водоотнимающего компонента фторида бора. Его введение в реакционный процесс позволяет снижать стоимость получаемого продукта, что делает доступным нитрование толуола. Уравнение протекающего процесса в общем виде представлено ниже:
ArH + HNO3 + BF3= Ar-NO2 + BF3 ·H2 O
После завершения взаимодействия вводят воду, благодаря чему моногидрат фторида бора образует дигидрат. Его отгоняют в вакууме, затем добавляют фтористый кальций, возвращая соединение в исходный вид.
Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

Специфика нитрования
Есть некоторые особенности данного процесса, связанные с выбором реагентов, субстракта реакции. Рассмотрим некоторые их варианты подробнее:
- 60-65 процентная азотная кислота в смеси с 96 процентной серной кислотой;
- смесь 98 % азотной кислоты и концентрированной серной кислот подходит для мало реакционных органических веществ;
- нитрат калия или аммония с концентрированной серной кислотой — это отличный выбор для производства полимерных нитросоединений.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Кинетика нитрования
Ароматические углеводороды, взаимодействующие со смесью серной и азотной кислот, нитруются по ионному механизму. В. Марковникову удалось охарактеризовать специфику данного взаимодействия. Процесс протекает в несколько стадий. Сначала образуется нитросерная кислота, которая подвергается диссоциации в водном растворе. Ионы нитрония вступают во взаимодействие с толуолом, образуя в качестве продукта нитротолуол. При добавлении в смесь молекул воды происходит замедление процесса.
В растворителях с органической природой — нитрометане, ацетонитриле, сульфолане — образование этого катиона позволяет увеличивать скорость нитрования.
Полученный катион нитрония прикрепляется к ядру ароматического толуола, при этом образуется промежуточное соединение. Далее происходит отрыв протона, приводящий к формированию нитротолуола.
Для детального описания происходящего процесса можно рассмотреть образование «сигма» и «пи» комплексов. Образование «сигма» комплекса является лимитирующей стадией взаимодействия. Скорость реакции будет напрямую связана с быстротой присоединения катиона нитрония к атому углерода в ядре ароматического соединения. Отщепление протона от толуола осуществляется практически мгновенно.
Только в некоторых ситуациях могут возникать какие-то проблемы с замещением, связанные с существенным первичным кинетическим изотопным эффектом. Это связано с ускорением обратного процесса при наличии препятствий разного вида.
При выборе в качестве катализатора и водоотнимающего средства концентрированной серной кислоты наблюдается смещение равновесия процесса в сторону образования продуктов реакции.
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

Заключение
При нитровании толуола образуется нитротолуол, который является является ценным продуктом химической промышленности. Именно это вещество является взрывчатым соединением, поэтому востребовано на взрывных работах. Среди экологических проблем, связанных с его промышленным изготовлением, отметим использование существенного количества концентрированной серной кислоты.
Для того чтобы справиться с такой проблемой, химики ищут способы уменьшения сернокислотных отходов, получаемых после проведения процесса нитрования. Например, процесс осуществляют при пониженных температурах, применяют легко регенерируемые среды. Серная кислота обладает сильными окислительными свойствами, что негативно отражается на коррозии металлов, представляет повышенную опасность для живых организмов. При соблюдении всех норм безопасности можно справиться с этими проблемами, получать нитросоединения высокого качества.
Видео:Азотная кислота. Химические свойства. Реакции с НЕметаллами.Скачать

Уравнение реакции толуола с азотной кислотой
Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
Реакции замещения
1. Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
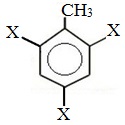
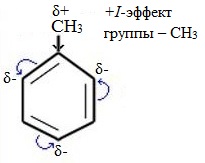
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
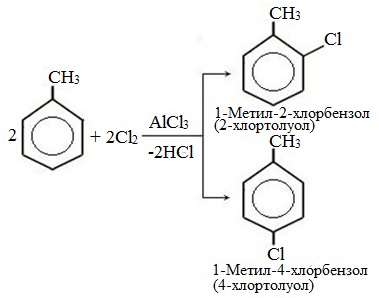
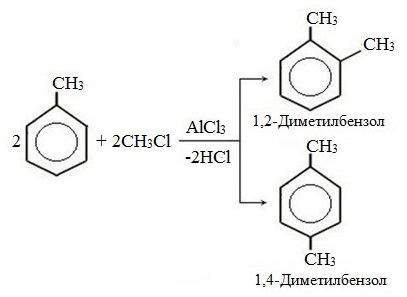
а) галогениерование
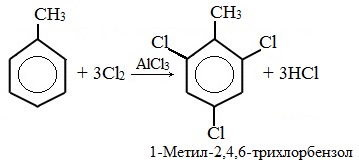
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
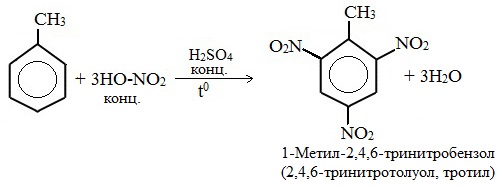
б) нитрование
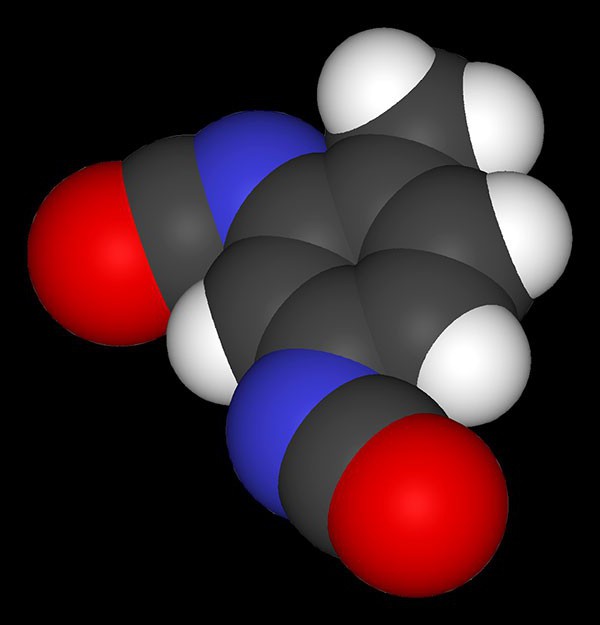
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
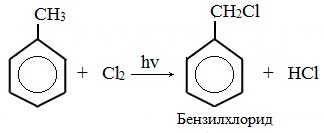
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
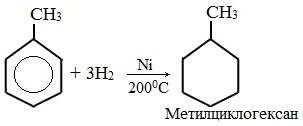
Реакции присоединения
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
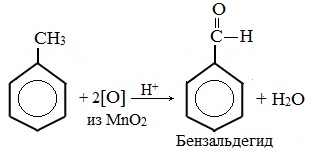
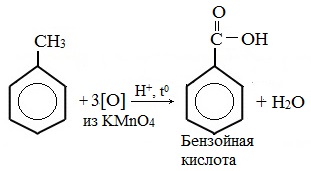
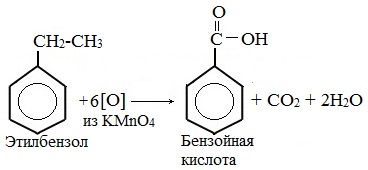
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
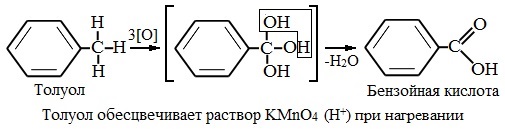
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
Видео:Синтез БЕНЗОЙНОЙ КИСЛОТЫ из ТОЛУОЛА. Реакция ПЕРМАНГАНАТА КАЛИЯ и ТОЛУОЛА. Опыты по химии дома.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎥 ВидеоХимические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать  КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Получение НИТРОЦЕЛЛЮЛОЗЫ. Реакция целлюлозы (ваты) азотной и серной кислот. Опыты по химии.Скачать  Реакции металлов с азотной кислотой. Химический опытСкачать  Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать  Синтез о нитротолуола (Synthesis of o-nitrotoluene )Скачать  Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать  реакция меди с азотной кислотойСкачать  Азотная кислота. Химические свойства. Взаимодействие с металламиСкачать  Азотная кислота. Физические и химические свойства. 9 класс.Скачать  Азотная кислота ЕГЭ / ОВР / нитраты / химические свойства / химия 2022 (#ИзиХим)Скачать  |