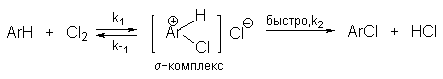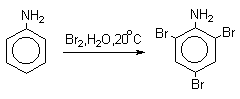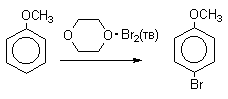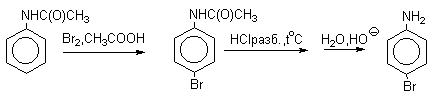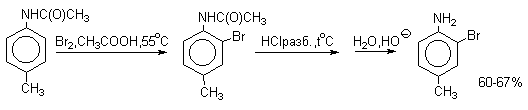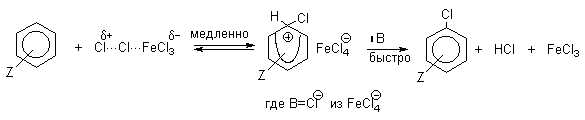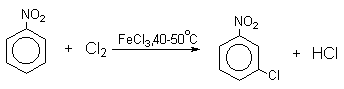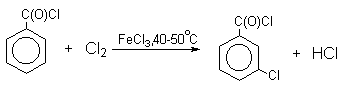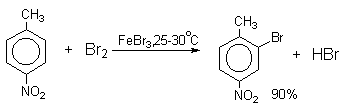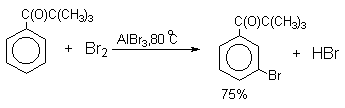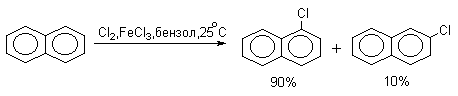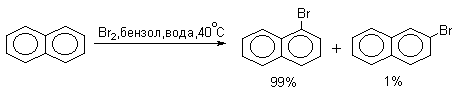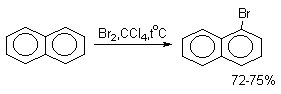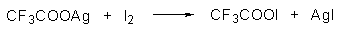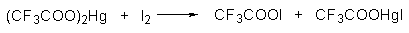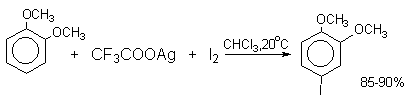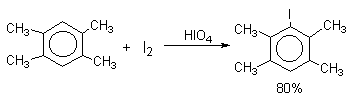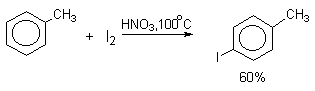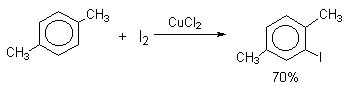Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Ваш ответ
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Похожие вопросы
- Все категории
- экономические 43,405
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,990
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Уравнение реакции толуол и бром на катализаторе febr3
3.2. Галогенирование
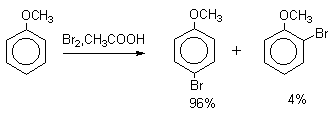
В реакциях замещения аренового водорода на галогены активность галогенов уменьшается в ряду Cl2>Br2>>I2. В качестве электрофильных галогенирующих агентов используются молекулярные галогены или комплексы галогенов с разнообразными кислотами Льюиса (FeCl3, FeBr3, AlCl3, AlBr3 галогениды Ga,Sb,Sn,TiCl4 и др.). Очень часто применяют растворы Сl2 и Br2 в уксусной кислоте.
Галогенирование аренов молекулярными галогенами в отсутствие кислот Льюиса или Бренстеда, поляризующих связь галоген-галоген, эффективно лишь для полиалкилбензолов, фенолов, простых эфиров одно- и многоатомных фенолов, и ароматических аминов. В других случаях необходим катализ кислотами Льюиса или Бренстеда. Активные субстраты хлорируются хлором в уксусной кислоте, где электрофилом является просто элементарный хлор. Реакция имеет второй кинетический порядок (скорость=k[ArH][Cl2]). На ее скорость не влияют добавки сильных кислот или оснований. При добавлении ионов Cl- (общий ион) и СH3COO- в обоих случаях проявляется лишь нормальный солевой эффект. На основании этого можно сделать вывод, что электрофилами в этом случае не являются ни Cl+ , ни CH3COОCl. Поэтому был предложен очень простой двухстадийный механизм:
Такой же механизм наблюдается и в других органических растворителях.
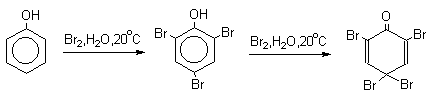
Бромирование происходит аналогично, однако при сохранении первого порядка по ArH, порядок по брому часто отличается от первого. Вероятно, это связано с более легкой обратимостью первой стадии. Галогенирование свободными галогенами активных ароматических субстратов протекает очень легко и часто приводит к полигалоидпроизводным. Например, анилин и фенол при действии бромной воды мгновенно превращаются в нерастворимые 2,4,6-трибромпроизводные, причем в случае фенола при избытке бромной воды реакция протекает более глубоко.
Поэтому, для получения моногалоидзамещенных производных фенола и анилина используют специальные приемы:
- Понижают активность галогена и увеличивают»объем» галогенирующей частицы (например, используют комплексы хлора и брома с уксусной кислотой, комплекс брома с диоксаном — диоксанбромид).
- Понижают активность субстрата и увеличивают «объем» ориентирующего заместителя (например, ацилируют NH2-группу в анилине).
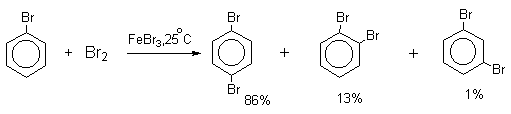
Механизм галогенирования при катализе кислотами Льюиса или Бренстеда часто называют галогенированием «положительным бромом» или «положительным хлором», но эти названия чисто условны. При бромировании бромом в присутствии кислот Льюиса в этих реакциях участвует комплекс галогена с кислотой Льюиса, например, [Br + . Br-FeBr3 — ]. В качестве катализатора обычно берут FeCl3 или FeBr3, которые можно получать из металлического железа и Cl2 или Br2 прямо в реакционном сосуде. Более активные катализаторы AlCl3 или AlBr3 нередко приводят к образованию продуктов полигалогенирования. Так, например, при бромировании бензола в присутствии AlBr3 замещаются все шесть атомов водорода и образуется гексабромбензол. Поэтому AlHal3 мало пригодны для галогенирования бензола, моно- и диалкилбензолов, галогенбензолов. Сильные кислоты Льюиса эффективны при галогенировании нитробензола, бензойной кислоты и других соединений, содержащих электроноакцепторные заместители. Во всех случаях атакующим агентом, по-видимому, является комплекс Hal2 с кислотой Льюиса. До сих пор нет прямых доказательств участия в реакции катионов Cl + или Br + , как кинетически независимых частиц.
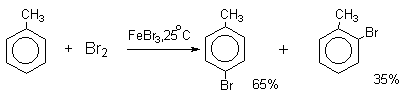
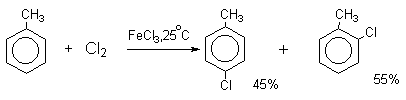
Толуол в присутствии FeBr3, бромируется существенно быстрее, чем бензол (kтолуол/kбензол=160). При этом получается смесь пара- и орто-изомеров в соотношении
2:1, и совсем не получается мета-изомера, а при хлорировании толуола орто- и пара-изомеры образуются в примерно равных количествах.
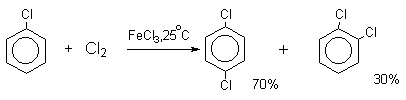
Следует также отметить, что введение хлора или брома в бензольное кольцо уменьшает скорость дальнейшего замещения не более чем в 7-8 раз в отличие от нитрования, где скорость реакции введения второго заместителя уменьшается в 10 7 раз. Поэтому хлорирование и бромирование бензола всегда приводит к смеси дигалогенпроизводных. При хлорировании хлорбензола сначала образуется смесь орто- и пара-дихлорбензолов в соотношении 3:7, а при дальнейшем хлорировании получается смесь 1,2,3- и 1,2,4-трихлорбензолов.
Напротив, каталитическое галогенирование соединений с электроноакцепторными заместителями протекает более селективно.
Нафталин галогенируется гораздо легче, чем бензол. Реакцию можно проводить как в присутствии кислоты Льюиса, так и без нее.
Бром реагирует еще более селективно, чем хлор:
Широкое применение в синтетической практике находят такие галогенирующие агенты, как трифторацетилгипобромит и особенно трифторацетилгипоиодит (CF3COOHal). Эти гипогалогениты образуются при действии соответствующего галогена на трифторацетаты серебра или ртути.
Можно использовать также ацетилгипогалогениты, однако трифторацетилгипогалогениты гораздо более реакционноспособны. Например, скорости бромирования при действии Br2, CH3COOBr и CF3COOBr составляют 1:10 6 :10 10 .
Молекулярный иод является слишком слабым электрофильным агентом. Только очень активные ароматические соединения, такие, как ароматические амины или фенолят-ион реагируют непосредственно с I2. В качестве более активного иодирующего агента иногда используют хлорид иода ICl. Удобным методом иодирования ароматических соединений является использование смеси молекулярного иода и окислителей (окислительное иодирование), лучшим из которых является, по-видимому, HIO4, но азотная кислота употребляется наиболее часто, как более дешевая.
Очень хорошие результаты получаются при иодировании ароматических соединений смесью I2 с хлоридом меди (II) CuCl2. Хлорная медь выполняет, вероятно, двоякую функцию и кислоты Льюиса и окислителя:
Ввиду чрезвычайной активности фтора, прямое фторирование практически не применяют для введения фтора в ароматическое кольцо. Арилфториды получают термическим разложением тетрафторборатов арилдиазониев (реакция Шимана).
Видео:Влияние катализатора на скорость химических реакцийСкачать

смесь толуола и гексана обработали бромом в пребывании катализатора FeBr3 при
Смесь толуола и гексана обработали бромом в пребывании катализатора FeBr3 при этом было получено 5,13 г бромпроизводного. такое же количество той же смеси при реакции с парами брома при освещении образует 10,08 г консистенции бромидов. высчитайте массовые доли углеводородов в смеси при условии, что при реакции образуется только их монобром производные.
- Сема
- Химия 2019-09-16 18:04:51 1 1
CH-CH + Br = CHBr-CH + HBr— (в пребывании катализатора FeBr3 с бромом реагирует только толуол)
n(CH-CH) = n(CHBr-CH)
На свету:
CH-CH + Br = CH-CHBr + HBr
n(CH-CH) = n(CH-CHBr), не считая того CHBr-CH и CH-CHBr — это изомеры и их молекулярные массы равны.
CH + B = CHBr + HBr
n(CHBr-CH ) = m/M = 5,13 г. : 171 г/моль= 0,03 моль
так как n(CH-CH) = n(CHBr-CH ),
то m( CH-CH) = n*M = 0,03 моль * 92 г/моль = 2,76 г.
m( CHBr) = 10,08 г. — 5,13 г. = 4,95 г.
n( CHBr) = m/M = 4,95 г./165 г/моль = 0,03 моль
m( CH) = n*M = 0,03 моль * 86 г/моль = 2,58 г.
m(смеси) = m( CH-CH) + m(CH ) = 2,76г. + 2,58 г.= 5,34 г.
( CH-CH) = 2,76 г. : 5,34 г. * 100% = 51,69%
(CH) = 2,58 : 5,34 г. * 100% = 48,31%
📺 Видео
Арены. Химические свойства. Все 22 реакции ЕГЭ.Скачать

Катализ. 10 класс.Скачать

253) Каталитические реакции, катализатор (материаловедение)Скачать

6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Влияние катализатора на скорость реакцийСкачать

Химия. 10 класс. Катализаторы и ингибиторы. Катализ: гомогенный и гетерогенныйСкачать

§6, 9 кл. Катализаторы и катализ. Видеоуроки по химииСкачать

СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. КАТАЛИЗАТОР.Скачать

Бромирование бензолаСкачать

Каталитическое и некаталитическое разложение хлората калия бертолетовой солиСкачать

Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Бромирование БензолаСкачать

Практическая работа №3 «Влияние катализатора на скорость реакции» 9 классСкачать

25. Схема реакции и химическое уравнениеСкачать

КАК определить ЗАБИТЫЙ КАТАЛИЗАТОР | Признаки неисправности КАТАЛИЗАТОРА #1Скачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать