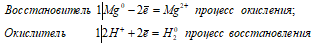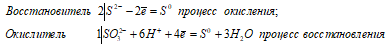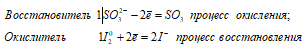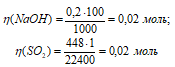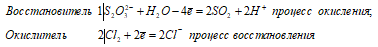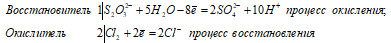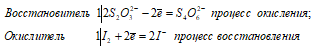Ну как вам опыты с жесткой водой? Заметили, как стирают порошок и мыло в жесткой воде? Совсем скоро я планирую показать еще несколько опытов про стиральный порошок, нашла просто отпадный материал, в том числе и видео. Так что, не пропустите выход этой статьи!
А сегодня предлагаю заняться выведением пятен, а именно пятен от йода. Мы проведем несложные опыты с йодом, тиосульфатом натрия и узнаем, чем обесцветить йод.
В этом нам поможет волшебный тиосульфат натрия, который можно легко купить в аптеке и с его помощью обесцветить йод. Это вещество используется при различных отравлениях, например, соединениями мышьяка, ртути, свинца, солями йода и брома. Он недорогой и хватит его надолго. Вот сегодня мы и посмотрим, как тиосульфат вступает в реакцию с йодом.
- аптечная спиртовая настойка йода
- картофельный крахмал
- вода
- аптечный раствор тиосульфата натрия, например, вот такой:
Готовим раствор крахмала. Для этого треть чайной ложки крахмала растворяем в небольшом количестве холодной воды и хорошенько размешиваем:
Готовим светло-коричневый раствор йода. Для этого к небольшому количеству воды добавляем 1-2 капли аптечного йода:
Теперь добавляем немного полученного йодного раствора к раствору крахмала – появляется синее окрашивание. С таким мы уже сталкивались в опытах с крахмалом.
Ну а теперь – самое интересное. К синему раствору приливаем содержимое одной ампулы с тиосульфатом натрия. Синяя окраска мгновенно исчезает.
Объяснение происходящего очень простое.
При взаимодействии йода и крахмала всегда появляется синяя окраска. Это качественная реакция на йод. Но йод взаимодействует и с тиосульфатом натрия. Поэтому когда мы приливаем тиосульфат к синему раствору крахмала, весь йод вступает в реакцию с тиосульфатом, следовательно, крахмал, освобожденный от влияния йода, снова становится бесцветным.
Для подтверждения этого можете прилить тиосульфат к оставшемуся раствору йода. Видите, он мгновенно обесцвечивается:
- аптечная спиртовая настойка йода
- небольшой кусочек ткани, лучше белой или хотя бы светлой
- кусочек ваты
- аптечный раствор тиосульфата натрия
Пипеткой капнем каплю йода на ткань. Образуется яркое коричневое пятно:
Теперь смочим ватку в растворе тиосульфата и протрем это пятно. Оно мгновенно исчезает:
Так что, теперь, если вы вдруг испачкаете свою одежду йодом, вы знаете, как можно избавиться от пятна.
Кстати, помните, когда-то я писала про самодельные краски из крахмала? Я уже, честно говоря, и забыла про них, а вот мой ребенок периодически вспоминает и требует, чтобы мама достала «Мишку» порисовать. И с удовольствием рисует. Может, кто-нибудь подскажет, где еще можно купить вот такие банки необычной формы? Я бы еще красок наделала, раз уж ребенку так нравится.
Наталья Брянцева
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+ , В контакте , Одноклассники , Facebook
Видео:Йод и тиосульфат натрияСкачать

Реакция взаимодействия тиосульфата натрия и иода
Видео:Взаимодействие йода с тиосульфатом натрия.Скачать

2Na2S2O3 + I2 → Na2S4O6 + 2NaI
Реакция взаимодействия тиосульфата натрия и иода с образованием тетратионата натрия и иодида натрия. Тиосульфат натрия — разбавленный раствор.
Реакцию широко используют в аналитической химии для иодометрического определение восстановителей и окислителей.
Видео:Обесцвечиваем йод. Тиосульфат натрия+крахмал против йода. Эксперимент #2Скачать

Характеристика окислительно-восстановительных свойств сернистой кислоты
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Mg 0 + 2H + = Mg 2+ + H2 0
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
2S 2- + SO3 2 — + 6H + ↔ 3S 0 + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Видео:КАК УРАВНЯТЬ I2 + Na2S2O3 = Na2S4O6 + NaI электронным балансом? РЕАКЦИЯ ЙОДА С ТИОСУЛЬФАТОМ НАТРИЯСкачать

Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na 2SO 3) = M( Na 2SO 3) . n( Na 2SO 3) = 126 . 0,01 = 1,26 г.
Ответ: m( Na 2SO 3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
S2O3 2- + 2Cl2 0 + H2O ↔ 2SO 2 ↑ + 4Cl — + 2H +
Na 2 S 2 O 3 + 2Cl 2 + H 2 O ↔ 2NaCl + 2SO 2 ↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8C l- + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ + 2H 2 SO 4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2 Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H 2 S 4 O 6 .
📽️ Видео
Качественная реакция тиосульфат - иона. Реакция раствора тиосульфата натрия с соляной кислотой 🧪Скачать

РЕАКЦИЯ Алюминия, Тиосульфата Натрия И Соляной Кислоты. Реакция Al, Na2S2O3, HCl.Скачать

КАК УРАВНЯТЬ I2 + Na2S2O3 = Na2S4O6 + NaI методом полуреакций? РЕАКЦИЯ ЙОДА С ТИОСУЛЬФАТОМ НАТРИЯСкачать

Реакция Йода И Гидроксида Натрия. Реакция I2 и NaOH.Скачать

Химическая реакция йода и алюминия.Скачать

Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

Занятие 5. Стандартизация тиосульфата натрия по дихромату калия.Скачать

ПОЛУЧЕНИЕ Тиосульфата Натрия. Реакция Сульфита Натрия и Серы.Скачать

42. Зависимость скорости реакции тиосульфата натрия с серной кислотой от концентрации реагентовСкачать

Реакция тиосульфата натрия и соляной кислотыСкачать

Как отмыть йод / зелёнку? Химия – ПростоСкачать

Стандартизация раствора натрия тиосульфата по калия дихроматуСкачать

Йодид Олова(4) - SnI4. Реакция Олова и Йода. Реакция Sn и I2.Скачать

Йодид Ртути(1) - Hg2I2. Реакция Ртути И спиртового раствора Йода. Реакция Hg и I2.Скачать

Кузьмич Е.С. Приготовление и установка титра раствора йода.Скачать

Йод - САМЫЙ КРАСОЧНЫЙ ЭЛЕМЕНТ НА ЗЕМЛЕ!Скачать