| Тетраборат натрия | |
|---|---|
 | |
 | |
| Традиционные названия | бура, боракс |
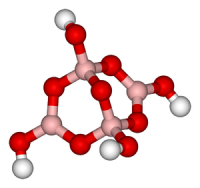
| Хим. формула | Na2B4O7 |
| Состояние | кристаллы |
| Молярная масса | 201,22 г/моль |
| Плотность | 2,37 ± 0,01 г/см³ |
| Т. плав. | 664 °C (β-модификация) 710 °C (γ-модификация) |
| Т. кип. | 1575 °C |
| Т. разл. | 2867 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 3,2 г/100 мл (25 °C) 10,5 г/100 мл (50 °C) |
| Растворимость в этаноле | 0,05 г/100 мл |
| Растворимость в ацетоне | 0,006 г/100 мл |
| ГОСТ | ГОСТ 8429-77 |
| PubChem | 10219853 |
| SMILES | |
| Кодекс Алиментариус | E285 |
| RTECS | VZ2275000 и ED4588000 |
| ChemSpider | 8395345 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Тетраборат натрия («бура», «боракс» (от лат. borax )) — неорганическое соединение, натриевая соль борной кислоты с химической формулой Na2B4O7, наиболее распространённое и используемое соединение бора, образует несколько кристаллогидратов, широко применяется в промышленности.
Видео:Реакция Тетрабората Натрия С Солями Щелочноземельных Металлов. Реакция Na2B4O7 с MgCl2, CaCl2.Скачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Нахождение в природе
Видео:Получение ТРИФТОРИДА БОРА. Реакция Фторида Натрия, Тетрабората Натрия и Серной Кислоты.Скачать

Физические свойства
Имеет две метастабильные модификации: β и γ. β-модификация является ромбической с температурой плавления 664 °C, γ-модификация — моноклинная с температурой плавления 710 °C. Температура кипения — 1575 °C. Расплав застывает в стекловидную массу с плотностью 2,36 г/см 3 .
Видео:Реакции разложения. Как понять?Скачать

Химические свойства
Растворимость в воде составляет 3,2 г / 100 мл (25 °C), 10,5 г / 100 мл (50 °C), в этаноле — 0,05 г / 100 г (25 °C), ацетоне — 0,006 г / 100 г (25 °C), не растворим в диэтиловом эфире и глицерине. Реагирует с метанолом при растворении с образованием бороорганических соединений.
Образует несколько кристаллогидратов с разным содержанием воды. Эти кристаллогидраты и безводный тетраборат натрия Na2B4O7 обычно называют «бура». Примеры кристаллогидратов:
Однако наиболее часто «бурой» называют декагидрат Na2B4O7·10H2O. Эта соль представляет собой прозрачные кристаллы с молярной массой 381,43 г/моль, имеющие хорошую растворимость в тёплой воде. При нагревании свыше 400 °C полностью теряет кристаллизационную воду.
Так как тетраборат натрия является солью слабой кислоты и сильного основания, в воде гидролизуется. Водный раствор тетрабората натрия имеет щелочную реакцию.
Взаимодействует с сильными кислотами, образуя соответствующую соль и борную кислоту:
Многие соли металлов борной кислоты нерастворимы в воде и при взаимодействии в растворе их растворимых солей с тетраборатом натрия образующиеся бораты выпадают в осадок. На этом основано применение буры для «умягчения» воды:
С оксидами многих переходных металлов бура при сплавлении образует разнообразно окрашенные соединения — бораты «перлы буры». По окраске перлов можно судить о качественном химическом составе пробы.
Окрашивает пламя горелки в зелёный цвет (характерная реакция на соединения бора).
Видео:9. ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ НИТРАТОВ/ Нужно знать/ ЕГЭ химия 2020Скачать

Получение
Десятиводную соль Na2B4O7·10H2O получают из природных минералов, например, буры или кернита, осуществляя их перекристаллизацию. Также для этой цели применяют химическое взаимодействие некоторых природных боратов (ашарита и улексита) с карбонатом или гидрокарбонатом натрия.
Может быть получен реакцией карбоната натрия и борной кислоты при нагреве, пропусканием углекислого газа через растворметабората натрия.
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Применение
Тетраборат натрия применяется:
- как сырьё для получения борной кислоты и различных соединений бора;
- в производстве эмалей, глазурей, оптических и цветных стёкол, различных керамик;
- при пайке и плавке металлов в составе флюса;
- в бумажной и фармацевтической промышленности;
- в производстве строительных материалов как компонент антисептика для изготовления целлюлозного утеплителя «Эковата»
- как дезинфицирующее и консервирующее средство;
- для приготовления буферных растворов;
- в аналитической химии:
- как стандартное вещество для определения концентрации растворов кислот;
- для качественного определения оксидов металлов (по цвету перлов);
- в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества;
- как компонент моющих средств;
- как компонент косметики;
- как инсектицид в отравленных приманках для уничтожения тараканов.
В 1977 году мировое производство тетрабората натрия составило 1,5 млн тонн.
Видео:Метаборат Кобальта - Co(BO2)2. Реакция Оксида Кобальта(2) и Тетрабората Натрия.Реакция CoO и Na2B4O7Скачать

Нахождение в природе
Существуют многочисленные минералы, содержащие тетраборат натрия. К ним относятся:
- бура (боракс, тинкал) — минерал состава Na2B4O7·10H2O — декагидрат тетрабората натрия;
- кернит — тетрагидрат тетрабората натрия — Na2B4O7·4H2O;
- многочисленные минералы класса боратов, в которых помимо оксидов натрия и бора содержатся другие металлы, — кальций, магний, железо и др.;
- кристаллогидраты тетрабората натрия выпадают в осадок при пересыхании некоторых бессточных, сезонно пересыхающих солёных озёр, например, в озере Серлс, расположенном в пустыне Мохаве в США, и некоторых озёр в Турции.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Уравнение реакции термического разложения тетрабората натрия


Самые низкие цены!
Химия со склада!
Большой ассортимент продукции на складе!
Видео:Сульфат Нитрожелеза(2) - [Fe(NO)]SO4. Реакция Нитрита Натрия, Серной кислоты и Сульфата Железа(2).Скачать
![Сульфат Нитрожелеза(2) - [Fe(NO)]SO4. Реакция Нитрита Натрия, Серной кислоты и Сульфата Железа(2).](https://i.ytimg.com/vi/FlTKUvWX9mU/0.jpg)
тетраборат натрия
• 2, 4, 6, 8, 9-pentaoxa-1, 3, 5, 7-tetraborabicyclo[3.3.1]nonane-3
Бура, также известная как натрий, тетраборат натрия или тетраборат динатрия, является важным соединением бора, минералом и солью борной кислоты. Обычно это белый порошок, состоящий из мягких бесцветных кристаллов, которые легко растворяются в воде. Термин «буракс» используется для ряда близкородственных минералов или химических соединений, которые различаются по содержанию их кристаллической воды, но обычно «бура» относится к декагидрату. Коммерчески продаваемая бура обычно частично обезвоживается. Тетраборат натрия используется в качестве пищевой добавки в некоторых странах, но запрещен в Соединенных Штатах. Как следствие, некоторые продукты, такие как икра, произведенная для продажи в США, содержат более высокие уровни соли, чтобы помочь в сохранении. В Индонезии тетраборат натрия является распространенной, но запрещенной добавкой к таким продуктам, как лапша, баксо (фрикадельки) и рис, приготовленный на пару. Дирекция по защите прав потребителей в стране предупреждает о риске развития рака печени с высоким уровнем потребления в течение 5-10 лет. тетраборат натрия — сложный боратный минерал, который встречается в плайа-озерах и других месторождениях эвапорита. Основная структура буры содержит цепи взаимосвязанных треугольников BO2 (OH) и тетраэдров BO3 (OH), связанных с цепями натриевых и водных октаэдров. Большинство старых минеральных образцов тетраборат натрия являются мелкими белыми из-за химической реакции от обезвоживания. Они фактически изменили (по крайней мере, на их поверхности) минеральный тинккалонит с потерей воды. Такое изменение от одного минерала к другому оставляет первоначальную форму кристалла. Минералоги называют это псевдоморфоном или «фальшивой формой», потому что цинкалконит имеет кристаллическую форму требуемой буры. тетраборат натрия непосредственно осаждается в засушливых регионах от испарения воды в прерывистых озерах, называемых playas. Плайас формируется только во время дождливых сезонов из-за стока из соседних гор. Этот сток богат элементным бором и высоко концентрирован путем испарения в засушливом климате. В конечном итоге концентрация настолько велика, что образуются кристаллы тетраборат натрия и других минералов бора. Наиболее коммерчески важные месторождения находятся вблизи Борона, Калифорнии и других мест на юго-западе США, пустыне Атакама в Чили и в Тибете. Бурак также может быть получен синтетически из других соединений бора. Тетраборат натрия происходит естественным образом в испаренных отложениях, образующихся при повторном испарении сезонных озер. Наиболее коммерчески важные месторождения находятся в Турции; Борон, Калифорния; И озеро Сирлес, штат Калифорния. Кроме того, пустыня Атакама в Чили, недавно открытые месторождения в Боливии, а также в Тибете и Румынии. Тетраборат натрия можно также синтезировать из других соединений бора. Естественно встречающаяся бура очищается процессом рекристаллизации. Тетраборат натрия, декагидрат тетрабората натрия, не является токсичным. Оценка LD50 (средняя летальная доза) оценивается в 2,66 г / кг у крыс. Значительная доза химического вещества необходима, чтобы вызвать серьезные симптомы или смерть. Смертельная доза не обязательно одинакова для людей. Достаточное воздействие пыли Тетраборат натрия может вызвать раздражение дыхательных путей и кожи. Проглатывание может вызвать желудочно-кишечные расстройства, включая тошноту, постоянную рвоту, боль в животе и диарею. Воздействие на сосудистую систему и мозг включает головные боли и летаргию, но они менее часты. Термин «буракс» часто используется для ряда близкородственных минералов или химических соединений, которые различаются по содержанию их кристаллической воды. Как долго бура использовалась человеком, вопрос вряд ли разрешится. Согласно легенде, вавилоняне принесли буры с Дальнего Востока более 4000 лет назад, чтобы их использовали ювелиры, и писания часто цитировали древних египтян как их использование в металлургии, медицине и мумификации, но ничто из этого не может быть обосновано. Нитрон-баурак из греков, борит евреев, баранка арабов, борек персов и буханка турок могут, как представляется, выражать одно и то же вещество, борат соды (то есть буру). Однако нет никаких доказательств того, когда или когда эти названия описывают вещество, которое мы теперь знаем как буру (Na2B4O7 · 10H2O). Фактически, это все транслитерации арабского слова, означающего «блеск». Кажется вероятным, что настоящая бура была известна и использовалась мастерами, учеными и алхимиками исламской цивилизации до 800 года н.э., и, возможно, торговцы Харун-аль-Рашида переправляли борат в Китай примерно в это время; Однако, если это так, его происхождение неизвестно. Только в средние века буря из Тибета регулярно импортировалась в Европу. Это было очень дорого, и это ограничивало его главным образом торговлей драгоценными металлами. Голдсмит использовал его в качестве паяльника и в рафинировании металлов и анализе руд. Количество торгуемых товаров было небольшим, его метод производства был секретным, и его источник оставался загадкой до второй половины 18 века. К началу 1500-х годов производство стекла широко практикуется в Европе, однако нет ссылок на использование буры. Пытаясь исправить первое использование буры в стекле, нужно помнить, что до 19-го века многие счета стекла были написаны наблюдателями, которые сами не были вовлечены в искусство. Техническая тайна была передана из уст в уста и практическим обучением, а тем, кто знал больше всего, не было дано писать на благо других. Самая ранняя ссылка на боросиликатное стекло поступает из Китая, где Чжао Рукуо описал стекольное производство арабами и другими в 1225 году: « Тетраборат натрия добавляется так, что стекло выдерживает самые сильные термические экстремумы и не трескается». Самое раннее европейское упоминание о буре в стекле происходит в немецкой работе Иоганна Кункеля в 1679 году, давая рецепты искусственных драгоценных камней. В 1739 году другой немецкий, Иоганн Крамер, рекомендовал для хрусталя три части готовых кремнеземов (кремнезем), одну часть чистейшей щелочной соли (поташ) и одну часть сожженной боровы (буры). В 1758 году Роберт Досси сообщил, что лучшие стеклянные пластины состоят из 56 процентов белого песка, 23,5 процента жемчужной золы (поташ), 14 процентов селитры и 6,5 процентов буры. Он также отмечает, что бура помогает стеклу получать определенные цвета.Borax имеет множество применений. Он наиболее известен тем, что он использует в стиральных и чистящих средствах, таких как «20 Мул Team Borax» и «Boraxo» порошок и мыло. Тетраборат натрия также используется в биохимических и химических лабораториях для изготовления буферов, например. Для электрофореза в железе ДНК, такого как TBE или новый SB-буфер или BBS (забуференный боратом физиологический раствор) в процедурах покрытия. Бутановые буферы также используются в качестве предпочтительного уравновешивающего раствора в реакциях сшивки на основе DMP. Тетраборат натрия является источником бората, который использовался для использования совместной комплексообразующей способности бората с другими агентами в воде с образованием сложных ионов с различными веществами. Бораты в качестве подходящего полимерного слоя используются в медицине для диагностики гипергликемии при сахарном диабете. Борат и запатентованная синтетическая аминокислота Deselex (от Henkel) использовались для усложнения катионов «твердости» воды, чтобы сделать «программное обеспечение» для не осаждающейся воды. Смесь бура хлорида аммония используется в качестве флюса при сварке железа и стали. Тетраборат натрия заменяет ртуть как предпочтительный метод извлечения золота в мелкомасштабных горнодобывающих предприятиях. Метод называется методом буры и используется на Филиппинах. Тетраборат натрия также используется для изготовления шпаклевки. Каучукоподобный полимер, иногда называемый флюкбером, клеем или глянцем, может быть получен путем сшивания поливинилацетата с бурой. Создание флюкбера из клея на основе поливинилацетата, такого как Elmer’s Glue, и буры, является общим экспериментом начального образования. Тетраборат натрия широко используется в детергентах, умягчителях для воды, мылах, дезинфицирующих средствах и пестицидах. Он используется для изготовления эмалированных глазурей, стекла и укрепления керамики и керамики. Он также легко превращается в борную кислоту или борат, которые имеют много применений. Смесь буры и хлорида аммония используется в качестве флюса при сварке железа и стали. Он снижает температуру плавления нежелательного оксида железа (шкала), позволяя ему убежать. Тетраборат натрия также используется в сочетании с водой в качестве флюса при пайке золота, серебра и т. Д. В ювелирных изделиях. Это позволяет расплавленному припою равномерно течь над рассматриваемым соединением. Borax — это ингредиент в слизе. Тетраборат натрия также используется при гидролизе казеина для приготовления молочной краски. Казеин действует как связующее вещество для пигментов и является естественным компонентом молока. Он производится путем осаждения из молока ферментом или кислотой и затем превращается в клейкий казеиновый клей с помощью щелочи, такой как бура. Казеин является одним из первых связующих, когда-либо используемых человечеством. Казеин можно нанести на различные поверхности, включая древесину и штукатурку. Используемая поверхность всегда должна быть жесткой, поскольку казеин слишком хрупкий, чтобы нарисовать на гибких поверхностях, таких как холст. Казеин также является эмульгатором, что позволяет комбинировать масло и воду. Из методов изготовления казеиновой краски Тетраборат натрия -казеин легче использовать и лучше подходит в качестве пигментного связующего. Он используется для изготовления краски, которая обычно называется казеиновой температурой, но также может использоваться для изготовления большего количества краски для внутренних стен.
1
Внешний вид Тетраборат натрия
Белый, без запаха, кристаллический твердый
Удельный вес Тетраборат натрия
Растворимость в воде Тетраборат натрия
3,82% при 20 ° C; 51,2% при 100 ° С
Точка плавления Тетраборат натрия
PH: Тетраборат натрия
9,3 (3,0% раствор) при 20 ° C
Транспортировка и хранение.
Обращайтесь с сухим защитным газом. Держите контейнер плотно закрытым. Хранить в сухом прохладном месте в плотно закрытых контейнерах. Обеспечьте хорошую вентиляцию на рабочем месте. Открывайте и обрабатывайте контейнер с осторожностью. Информация о защите от взрывов и пожаров: Продукт не воспламеняется.
Требования, предъявляемые к складским помещениям и таре: Никаких особых требований. Информация о хранении в одном общем хранилище: Хранить вдали от воды / влаги. Хранить вдали от восстанавливающих агентов. Дополнительная информация о условиях хранения: Хранить в сухом инертном газе. Этот продукт гигроскопичен. Держите контейнер плотно закрытым. Хранить в прохладном, сухом состоянии в хорошо закрытых контейнерах. Защищайте от влаги и воды.
У Тетраборат натрия много применений, а также ингредиент в других продуктах. Вот некоторые виды применения порошка буры и чистой буры в воде:
• Тетраборат натрия Ингредиент в эмалированных глазури.
• Тетраборат натрия Компонент из стекла, керамики.
• Тетраборат натрия можно использовать в качестве добавки в керамических слипах и глазури для улучшения пригонки.
• Тетраборат натрия В производстве огнестойких материалов.
• Тетраборат натрия Противогрибковое соединение для стекловолокна и целлюлозной изоляции
• Тетраборат натрия 10% раствор для шерсти
• Тетраборат натрия Предшественник моногидрата пербората натрия, который используется в детергентах, а также для борной кислоты и других буровых растворов
• Тетраборат натрия Предшественник для борной кислоты, ингредиент клейкости в поливинилацетате, клей на основе поливинилового спирта
• Тетраборат натрия Детоксикация фторида
• Тетраборат натрия Лечение молочницы в копытах лошадей
• Тетраборат натрия Используется для изготовления несмываемых чернил для погружных ручек путем растворения шеллака в нагретой буре
• Тетраборат натрия Отвердитель для змеиных шкур
• Тетраборат натрия Отвердитель для яиц лосося, для использования в спортивной рыбалке для лосося
• Тетраборат натрия Буферный агент бассейна для контроля рН
• Тетраборат натрия Нейтронный поглотитель, используемый в ядерных реакторах и бассейнах отработавшего топлива для контроля реактивности и прекращения ядерной цепной реакции
• Тетраборат натрия В качестве микроэлементного удобрения для коррекции не содержащих бора почв
• Тетраборат натрия Для очистки полости головного мозга черепа для монтажа
• Тетраборат натрия Для окраски огней с зеленым оттенком
• Тетраборат натрия традиционно применяли для покрытия сухих замороженных мясных продуктов, таких как ветчины, чтобы защитить их от взрыва в процессе дальнейшего хранения
• Тетраборат натрия Обнаружен в некоторых коммерческих витаминах
• Тетраборат натрия Для остановки радиатора автомобиля и утечек блока двигателя
• Тетраборат натрия Как важный компонент в слизе
• Тетраборат натрия Используется современным кузнецом в процессе сварки фортом
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Уравнение реакции термического разложения тетрабората натрия
БУРА (декагидрат тетрабората натрия Na2B4O7·10 H2O) – большие бесцветные кристаллы, растворимые в воде, которые в сухом воздухе выветриваются c поверхности и плавятся при 61° С, при 320–380° С теряет кристаллизацонную воду. Безводный тетраборат натрия – бесцветное кристаллическое вещество с плотностью 2,367 г/см3, плавится при 741° С без разложения. Термически неустойчивым тетраборат натрия становится только при 1575° С. Коэффициент растворимости (в г на 100 г воды) равен 2,5 (при 20° С) и 24,3 (при 80° С).
В природе бура встречается главным образом в воде и донных осадках некоторых озер. Такие озера – не редкость в Индии и Тибете; природная бура из тех мест – минерал тинкал. В средневековые времена добытую здесь буру грузили в мешки из слоновых шкур и везли в Венецию, где очищали от примесей путем кристаллизации из водного раствора. Способы получения буры сохранялись в строжайшей тайне, их не знали даже европейские алхимики.
Тем не менее, алхимики отличали буру от соды, хотя как именно они это делали, неизвестно: ведь оба вещества схожи в том, что дают щелочную среду при растворении в воде и поэтому вытесняют аммиак из хлорида аммония.
Щелочная реакция раствора тетрабората натрия обусловлена тем, что в водном
растворе протекает реакция гидролиза c образованием в растворе борной кислоты B(OH) 3:
B4O7 2– + 7H2O 
а выделение аммиака при взаимодействии с NH4Cl отвечает уравнению:
Хотя в 16–17 вв. химики не имели представления о точном составе получаемых и используемых ими веществ, а об их свойствах судили по самым примитивным признакам, вроде пробы на вкус, им удавалось иногда сделать замечательные открытия. Так, голландский алхимик Вильгельм Гомберг, нагревая буру с серной кислотой H2SO4, выделил борную кислоту B(OH)3.
При этом протекала реакция:
А в 1751 Анри Дюамель де Монсо установил, что в составе буры, как и в составе соды, содержится элемент «натр». Можно только догадываться, как именно за три тысячи лет до нашей эры люди натолкнулись на буру. Возможно, индус-паломник, отдыхая на берегу озера, бросил в костер кусок неведомого белого вещества и заметил, что пламя стало зеленым, а вещество оплавилось и стало похоже на стекло. С этими особенностями буры были знакомы и жрецы Древнего Египта, которые умели делать пламя светильников зеленым. Позже, вероятно, обнаружили, что бура, как и сода, помогает отстирывать одежду от грязи (мыла еще не было). Постепенно люди научились использовать буру для дубления кож, в производстве стекла и глазурей, наконец, как лекарство – антисептик для промывания горла. Первое упоминание о буре в России встречается в 1709 в приходно-расходной книге Приказа рудных дел. В делах Петра I была найдена записка о необходимости получения буры из российских природных источников, которых оказалось немало. Тем не менее, буру еще долгое время ввозили в Россию из Венеции и из Англии.
В настоящее время буру используют очень широко: это антисептик и консервант, протрава (предварительная пропитка) для окрашивания тканей, сырье для получения борной кислоты, гербицидов, средств замедления коррозии (ингибиторов), моющих средств (умягчитель воды). Кроме того, бура служит одним из компонентов шихты (исходной смеси веществ) при получении глазурей, стекла и керамики.
Каждый ювелирных дел мастер привык иметь дело с бурой – это незаменимая составная часть флюсов при сварке и спайке благородных металлов (золота и серебра).
🎦 Видео
Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Натрий - Na. Разложение Азида Натрия. Разложение NaN3.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение нитратов за 5 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Фтористый Хромил - CrO2F2. Реакция Дихромата Калия, Фторида Натрия и Серной кислоты.Скачать

Разложение нитратовСкачать

Классификация и скорость химических реакций: задания 17 и 18 | Разбор заданий ЕГЭ по химииСкачать

Получение Оксида Кальция - CaO. Разложение Нитрата Кальция - Ca(NO3)2Скачать

Опыты по химии. Реакция нейтрализацииСкачать

Реакции разложенияСкачать