Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Задание 36 Окислительно-восстановительные реакции (стр. 6 )
- Acetyl
- 💡 Видео
Видео:перманганат калия + стиролСкачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Окисление органических соединений перманганатом калияСкачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:ОВР с перманганатом калия.Скачать
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Задание 36 Окислительно-восстановительные реакции (стр. 6 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
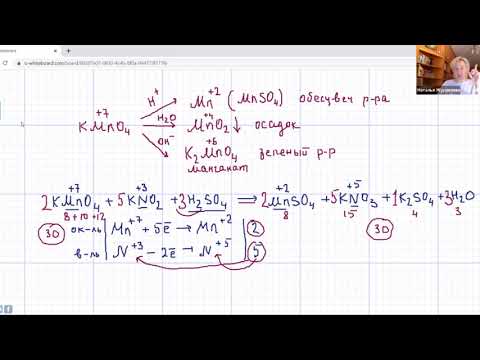
a. Окисление метилбензола перманганатом калия:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5С6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O

6 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5C7H8 + 10H2O + 6MnO4- + 48H+ → 5 C7H6O2 + 30H+ + 6Mn2+ +24H2O
б. Окисление этилбензола перманганатом калия:
5C6H5CH2-СН3 +12KMnO4 +18H2SO4 → 5С6H5COOH +5СО2 +12MnSO4+6K2SO4+28H2O

12 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5С8Н10 + 20H2O + 12MnO4- + 96H+ → 5С6H5COOH + 5СО2 + 60H+ + 12Mn2+ + 48H2O
в. Окисление стирола перманганатом калия:
С6Н5-СН═СН2 + 2KMnO4 + 3H2SO4 → С6H5COOH + СО2 + 2MnSO4 + K2SO4 + 4H2O

2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
С8Н8 + 4Н2О + 2MnO4- + 16H+ → С6H5COOH + СО2 + 10Н+ + 2Mn2+ + 8H2O
а. Окисление метилбензола перманганатом калия:
C6H5CH3 + 6KMnO4 + 7KOH → С6H5COOK + 5H2O + 6K2MnO4

6 MnO4- + e → MnO42- — восстановление
 |
C7H8 + 7OH — + 6MnO4- → C6H5COO — + 5H2O + 6 MnO42-
C6H5CH2 — СН3 + 12KMnO4 + 15KOH → С6H5COOK + К2СО3 + 12K2MnO4 + 10H2O

12 MnO4- + e → MnO42- — восстановление
 |
С8Н10 + 15OH — + 12MnO4- → C6H5COO — + СО32- + 10H2O + 24MnO42-
в. Окисление стирола перманганатом калия:
С6Н5-СН═СН2 + 10KMnO4 +13КОН →С6H5COOK + К2СО3 + 10K2MnO4 + 8H2O

10 MnO4- + e → MnO42- — восстановление
С8Н8 + 13OH — + 10MnO4- → C6H5COO — + СО32- + 8H2O + 10MnO42-
а. Окисление метилбензола перманганатом калия:
C6H5CH3 + 2KMnO4 → С6H5COOK + 2MnO2 + KOH + H2O

2 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
C7H8 + 7OH — + 2MnO4- + 4H2O → C6H5COO — + 5H2O + 2MnO2 + 8OH-
б. Окисление этилбензола перманганатом калия:
C6H5CH2 — СН3 + 4KMnO4 → С6H5COOK + К2СО3 + 4MnO2 + KOH + 2H2O

4 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
С8Н10 + 15OH — + 4MnO4- + 8H2O → C6H5COO — + СО32- + 10H2O + 4MnO2 + 16OH —
в. Окисление стирола перманганатом калия:


3 С8Н8 + 2OH — — 2е → С8Н8(ОН)2 — окисление
2 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
3С8Н8 + 6OH — + 2MnO4- + 4H2O → 3 С8Н8(ОН)2 + 2MnO2 + 8OH-
Окисление спиртов производят сильными окислителями KMnO4 или K2Cr2O7 в присутствии серной кислоты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
а. Окисление этанола:

H
5 C2H6O — 2e → C2H4O + 2H+ — окисление
2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
5C2H6O + 2MnO4- + 16H+ → 5C2H4O + 10H+ + 2Mn2+ + 8H2O
б. Окисление пропанола – 2:


5 C3H8O — 2e → C3H6 + 2H+ — окисление
2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
5C3H8O + 2MnO4- + 16H+ → 5C3H6 + 10H+ + 2Mn2+ + 8H2O
C избытком окислителя (KMnO4 или K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные — до кетонов. Третичные спирты не окисляются, а метанол окисляется до углекислого газа.
5СН3-СН2-ОН + 4KMnO4 + 6H2SO4 → 5СН3СООН + 4MnSO4 + 2K2SO4 + 11H2O
Двухатомные спирты окисляются до двухосновных карбоновых кислот.
5НО-СН2-СН2-СН2-ОН + 8KMnO4 + 12H2SO4 →
Альдегиды – сильные восстановители, поэтому легко окисляются при нагревании различными окислителями KMnO4 , K2Cr2O7 или [Ag(NH3)2]OH. Формальдегид с избытком окислителя окисляется до углекислого газа.
а. Окисление аммиачным раствором оксида серебра — качественная реакция на альдегиды
СН3С+1ОН + 2[Ag+1(NH3)2]OH → СН3С+3ООNH4 + 2Ag0 ↓ + H2O + 3NH3↑

2 Ag+1 + 1e → Ag0 — восстановление
б. Окисление перманганатом калия в кислой среде:
5СН3-СН2-СОН+2KMnO4 + 3H2SO4→5СН3-СН2-СООН +2MnSO4 + K2SO4 + 3H2O

2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5С3Н6О + 5Н2О + 2MnO4- + 16H+ → 5С3Н6О2 + 10Н+ + 2Mn2+ + 8H2O
в. Окисление перманганатом калия в щелочной среде:
СН3-СН2-СОН + 2KMnO4 + 3КОН → СН3СООК + 2K2MnO4 + 2H2O

2 MnO4- + e → MnO42- — восстановление
C2H4O + 3OH — + 2MnO4- → CH3COO + 2H2O + 2MnO42-
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl2 =CO2 
HCOOH+ Cl2 = CO2 
HOOC-COOH+ Cl2 =2CO2 
Все моносахариды — восстанавливающие сахара. Для них характерна реакция «серебряного зеркала».
а. Окисление глюкозы аммиачным раствором оксида серебра:
СН2ОН-(СНОН)4-С+1ОН + 2[Ag+1 (NH3)2]OH →

2 Ag+1 + 1e → Ag0 — восстановление
б. Окисление глюкозы фелинговой жидкостью:
СН2ОН-(СНОН)4-С+1ОН + Cu+2(OH)2 → СН2ОН-(СНОН)4-С+3ОOН + Cu2+1O + 2H2O

2 Cu+2 + 1e → Cu+1 — восстановление
в. Окисление глюкозы перманганатом калия в кислой среде:
5C6H12O6 + 24KMnO4 + 36H2SO4 → 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O

24 MnO4 — + 8H+ + 5e → Mn2+ + 4H2O — восстановление
C6H12O6 + 6О 2 → 6СО2 + 6Н2О
д. Брожение глюкозы:
Брожение – сложный процесс расщепления моносахаридов под влиянием различных микроорганизмов.
· спиртовое брожение: C6H12O6 → 2С2Н5ОН + 2СО2↑
· молочнокислое брожение: ферменты


· маслянокислое брожение: C6H12O6 → С3Н7СООН + 2СО2 ↑ + 2Н2↑


е. Восстановление глюкозы:
Все моносахариды при восстановлении образуют многоатомные спирты.
СН2ОН-(СНОН)4-С+1ОН + Н20 → СН2ОН-(СНОН)4-С-1 Н2OН+1

1 Н20 — 2е → 2 Н+1 — окисление

Видео:Арены: реакции окисления | Химия 10 класс | УмскулСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💡 ВидеоАрены. Химические свойства. Все 22 реакции ЕГЭ.Скачать  Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать  6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать  Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать  Реакция этилена с раствором перманганата калияСкачать  Все качественные реакции на углеводороды за 45 минут | Химия ЕГЭ для 10 класса | УмскулСкачать  Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Тесты по химии. Реакции орг веществ с перманганатом. А37 ЦТ 2006Скачать  Самый легкий способ уравнять ОВР в органике!Скачать  Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  Синтез БЕНЗОЙНОЙ КИСЛОТЫ из ТОЛУОЛА. Реакция ПЕРМАНГАНАТА КАЛИЯ и ТОЛУОЛА. Опыты по химии дома.Скачать  Получение ХЛОРА. Реакция СОЛЯНОЙ КИСЛОТЫ и ПЕРМАНГАНАТА КАЛИЯ. Химические опыты. Chemical experimentСкачать  |






































































