Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
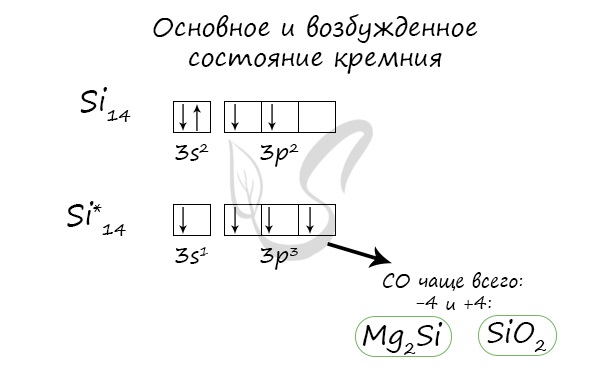
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Кремний
Кварц, горный хрусталь, аметист, халцедон, топаз, оникс… Трудно поверить, но все эти и многие другие «чудеса подземного мира» состоят из одного и того же вещества – кремнезема, или оксида кремния (IV) SiO2.
Предположения о том, что в кремнеземе содержится новый, еще неизвестный элемент, высказывались учеными уже в XVIII столетии. Однако в виде простого вещества кремний был выделен лишь в XIX в. Й. Я. Берцелиусом. Вначале он нагревал смесь кремнезёма с порошком железа и углём до 1500 0 С, но чистый кремний получить не удавалось: в присутствии железа образуется ферросилиций – сплав, содержащий оба эти элемента. Поняв, в чем ошибка, Берцелиус изменил способ синтеза. В 1823 г., когда он пропустил над калием пары фторида кремния (IV), удача, наконец, улыбнулась ему. По реакции SiF4 + 4K = Si + 4KF был получен порошок аморфного кремния. Берцелиус доказал также, что, сгорая на воздухе, кремний переходит в кремнезём.

По содержания в земной коре (28%) Si уступает только кислороду. В природе кремний встречается исключительно в форме соединений. Обычный речной песок представляет собой кремнезём, загрязненный примесью глины и соединений железа. Наряду с глиной (Al2O3∙2SiO2∙2H2O) он образуется при выветривании полевого шпата под действием углекислого газа и влаги воздуха:

Получение
В промышленности для получения кремния используют чистый песок SiO2. В электрических печах при высокой температуре происходит восстановление кремния из его оксида коксом (углем):
SiO2 + 2C = Si + 2CO↑
В лаборатории в качестве восстановителей используют магний или алюминий:
SiO2 + 2Mg = Si + 2MgO
Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом или цинком:
Физические свойства
Полученный указанными выше способами аморфный кремний представляет собой бурый порошок с температурой плавления 1420 0 С. Существует и другая аллотропная модификация кремния – кристаллический кремний. Это твердое вещество темно-серого цвета со слабым металлическим блеском, обладает тепло-и электропроводностью. Кристаллический кремний получают перекристаллизацией аморфного кремния. Аморфный кремний является более реакционноспособным, чем химически довольно инертный кристаллический кремний. Кристаллический кремний – полупроводник, его электропроводность возрастает при освещении и нагревании. Это обусловлено строением кристаллов. Структура кристаллического кремния аналогична структуре алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими и связан с ними ковалентной связью, хотя эта связь значительно слабее, чем между атомами углерода в алмазе. В кристалле кремния даже при обычных условиях ковалентные связи частично разрушаются, поэтому в нем имеются свободные электроны, которые обусловливают небольшую электропроводность. При освещении, нагревании, а также при наличии некоторых примесей увеличивается число разрушаемых связей, а значит, увеличивается число свободных электронов и возрастает электропроводность.
Химические свойства и применение
По химическим свойствам кремний во многом схож с углеродом, что объясняется одинаковой структурой внешнего электронного слоя. При обычных условиях кремний довольно инертен, что обусловлено прочностью его кристаллической решетки. Непосредственно при комнатной температуре он взаимодействует только с фтором. При температуре 400 – 600 0 С кремний реагирует с хлором и бромом, а в кислороде измельченный кремний сгорает. С азотом и углеродом кремний реагирует при очень высоких температурах. Во всех указанных реакциях кремний играет роль восстановителя.
Кремний как восстановитель взаимодействует и с некоторыми сложными веществами, например с фтороводородом:
С другими галогеноводородами он в реакцию не вступает.
Кремний не растворяется даже в азотной кислоте, так как на его поверхности образуется плотная оксидная пленка (SiO2), которая препятствует реакции. Однако со смесью HNO3 и HF кремний реагирует потому, что фтороводородная кислота растворяет SiF4:
Водные растворы щелочей растворяют кремний с образованием растворимых солей кремниевой кислоты – силикатов, при этом происходит выделение водорода:
Восстановительные свойства кремния используют для получения некоторых металлов из их оксидов. Например:
2MgO + Si = 2Mg + SiO2
При взаимодействии с металлами кремний играет роль окислителя. Соединения кремния с металлами называются силицидами:
При обработке силицида магния соляной кислотой или водой образуется простейшее водородное соединение кремния – силан SiH4:
Силан – ядовитый газ с неприятным запахом, легко самовоспламеняется на воздухе:
Кремний широко применяется в технике для получения различных полупроводниковых материалов и сплавов. Сплав кремния с железом – ферросилиций (сталь, содержащая 15% кремния) обладает большой кислотоустойчивостью. Из такой стали изготавливают химическую аппаратуру.
Оксид кремния (IV). Кремниевая кислота и ее соли. Стекло. Цемент
Оксид кремния (IV) SiO2 (кремнезем, ангидрид кремниевой кислоты) – твердое тугоплавкое вещество (температура плавления 1713 0 С), нерастворимое в воде, из всех кислот только фтороводородная кислота постепенно разлагает его:
Как кислотный оксид SiO2 при нагревании или сплавлении реагирует с основными оксидами, щелочами и некоторыми солями с образованием солей кремниевой кислоты – силикатов. Например:
Полученные искусственным путем силикаты натрия и калия – растворимое стекло – сильно гидролизованы. Их концентрированный раствор, называемый жидким стеклом, имеет сильнощелочную реакцию. Жидкое стекло применяется для изготовления несгораемых тканей, пропитки деревянных изделий, в качестве клея и т.д.
Кремниевая кислота H2SiO3 относится к очень слабым кислотам. В воде она практически нерастворима, но легко образует коллоидные растворы. Ее можно получить из растворов силикатов действием на них более сильных кислот. H2SiO3 выпадает из раствора в виде студенистого осадка (геля):
Постепенно при обычных условиях или быстрее при нагревании кремниевая кислота разлагается на воду и ангидрид кремниевой кислоты SiO2:
Стекло. Сырьем для производства стекла являются сода Na2CO3, известняк CaCO3 и песок SiO2. Из этих компонентов получают обычное оконное стекло:
В стекла особого назначения – огнеупорные, обладающие большой механической прочностью – при варке добавляют оксиды бария, свинца, бора. Окрашенные стекла получают добавлением оксидов кобальта (синее стекло), оксида хрома (зеленое стекло), добавлением оксида свинца получают хрустальное стекло.
Цемент представляет собой смесь силикатов, главными компонентами которых являются: оксид кальция, оксид кремния (IV), оксиды алюминия и железа (III).
В промышленности цемент получают спеканием глины и известняка СаСО3. Если образующийся при этом порошок смешать с водой, то получается масса, постепенно твердеющая на воздухе. При добавлении к цементу песка или щебня в качестве наполнителя получают бетон, который широко используют в строительстве. Прочность бетона возрастает, если в него вводится каркас из железных стержней. Железобетонные панели, блоки перекрытий – основа современного строительства.
Скачать:
Скачать бесплатно реферат на тему: «Кремний» КРЕМНИЙ.docx (226 Загрузок)
Скачать бесплатно реферат на тему: «Керамика» Керамика.docx (220 Загрузок)
Скачать бесплатно реферат на тему: «Бетон» Бетон.docx (232 Загрузки)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография аметиста
💥 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Изучаем химические свойства концентрированной серной кислоты!Скачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Серная кислота и ее соли. 9 класс.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Перекись водорода H2O2 + серная кислота H2S04 Потребляет практически любые органические вещества!Скачать

Качественная реакция ионов бария с серной кислотойСкачать

Реакция взаимодействия цинка и серной кислоты | Zn + H2SO4 → ZnSO4 + H2Скачать

Опасно для здоровья! ⚠️ Опыты с серной кислотойСкачать

Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать

В цеху серной кислоты. И всё о кислотахСкачать

Получение SiO2 и H2SiO3, диоксид кремния и не только!Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Получение угольной пены - Реакция сахара и серной кислоты!Скачать

Триоксид Серы(6). Разложение Сульфаминовой кислоты. Ангидрид Серной кислоты.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать