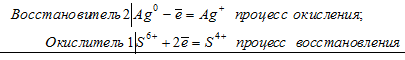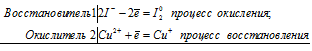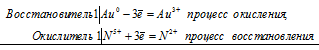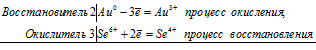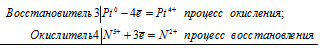Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
Серебро не взаимодействует с разбавленной серной кислотой, т. к. окислителем к ней являются протоны водорода, а серебро в ряду напряжения металлов стоит после водорода, поэтому серебро не может заместить водород из серной кислоты.
В концентрированной серной кислоте окислителем является сера в степени окисления +6, поэтому серебро растворяется (окисляется), восстанавливая при этом серу.
- Взаимодействие серебра с кислотами
- Как взаимодействуют кислоты с серебром?
- Взаимодействие серебра с соляной кислотой
- Взаимодействие серебра с серной кислотой
- Взаимодействие серебра с азотной кислотой
- Другие химические реакции серебра и кислот
- Составление окислительно-восстановительных реакций соединений серебра, золота и платины
- Уравнения взаимодействия KI с сульфатом меди
- 🔍 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Взаимодействие серебра с кислотами
В этой статьи мы рассмотрим вопросы химического взаимодействия серебра с различными кислотами. Содержание статьи является информативным, мы не рекомендуем производить химические реакции в домашних условиях, это может быть опасным.
Видео:Взаимодействие серной кислоты с металламиСкачать

Как взаимодействуют кислоты с серебром?
Серебро – химически малоактивно, поэтому его относят к семейству благородных металлов. В воздухе серебро (как химическое вещество) практически не окисляется, с водой не взаимодействует, является инертным металлом. Серебро в обычных условиях слабо взаимодействует с различными кислотами. Объясняется это тем фактом, что в электрохимическом ряду оно стоит после водорода. Серебро не вступает в химическую реакцию с соляной и разбавленной серной кислотой.
Серебро окисляется в реакции с горячей концентрированной серной кислотой и соляной кислотой в присутствии свободного кислорода. Серебро может вступать в химическую реакцию с кислотами, которые проявляют свойства окислителей, то есть содержать кислород.
Свойства серебра слабого взаимодействия с кислотами активно используется при производстве:
- серебряной посуды,
- серебряных ложек и вилок,
- серебряных ювелирных изделий,
- серебряных монет, наград и значков.
Серебро устойчиво к действию многих холодных и горячих кислот, щелочах и растворах солей, а также в ряде органических соединений. Холодная соляная кислота медленно действует на серебро благодаря образованию нерастворимой пленки из хлорида серебра.
В этой статье мы рассмотрим следующие химические реакции:
- реакция серебра и соляной кислоты;
- реакция серебра и серной кислоты;
- реакция серебра и азотной кислоты.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Взаимодействие серебра с соляной кислотой
Серебро не растворяется в соляной кислоте из-за появления тонкого слоя хлорида серебра. При условии добавления к раствору свободного кислорода в виде перекиси водорода реакция приведет к окислению серебра в хлорид серебра.
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Взаимодействие серебра с серной кислотой
Серебро реагирует с концентрированными растворами серной кислоты с образованием соли.
Разбавленная серная кислота при комнатной температуре не взаимодействует с серебром, концентрированная кислота — взаимодействует.
Видео:Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать

Взаимодействие серебра с азотной кислотой
Серебро реагирует с концентрированными растворами азотной кислот с образованием соли.
Химическая реакция — — > Ag +2HNO3 = AgNO3 + NO2 + H2O.
Химическая реакция — — > 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O.
Азотная кислота растворяет серебро при различных температурах и концентрациях, а царская водка образует на его поверхности нерастворимую пленку из хлорида серебра.
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Другие химические реакции серебра и кислот
Уксусная кислота не действует на серебро при низкой и высокой температурах, но при добавлении в нее небольшого количества соляной кислоты начинается растворение серебра.
Серебро не вступает во взаимодействие с фосфорной кислотой любой концентрации.
Авторские ювелирные брелоки по выгодной цене
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составление окислительно-восстановительных реакций соединений серебра, золота и платины
Задание 391
Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Серная кислота обладает окислительными свойствами (сходными со свойствами азотной кислоты), если её концентрация превосходит 70%. Только тогда можно говорить о специфических свойствах H2SO4, как окислителя. Концентрированная серная кислота, как окислитель восстанавливается активными металлами (от Mg Cr) до H2S, малоактивными металлами (от Fe до Pb) – до свободной серы, а тяжёлыми, инертными металлами (отSb до Au) – до оксида серы (IV). При содержании H2SO4 в растворе менее 70% (разбавленная серная кислота) её поведение описывается в рамках обычных представлений. При взаимодействии разбавленной серной кислоты с металлами, стоящими в электрохимическом ряду напряжений левее водорода, выделяется газообразный водород. С металлами, стоящими в ряду напряжений правее водорода, разбавленная серная кислота не взаимодействует.
В концентрированной серной кислоте элементом-окислителем является атом серы (степень окисления +6), а в разбавленной – водород (степень окисления +1).
Уравнение реакции растворения серебра в концентрированной серной кислоте
2Аg 0 + S 6+ = 2Ag + + S 4+
В данной реакции серебро увеличивает свою степень окисления от 0 до +1, т. е. проявляет свойства восстановителя, а сера уменьшает свою степень окисления от +6 до +4, т.е. проявляет свойства окислителя.
Задание 401
Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (II) в соединения меди со степенью окисления +1. Составьте электронные и молекулярные уравнения взаимодействия KI с сульфатом меди.
Решение:
Для меди характерна степень окисления +1 (Cu2O, CuCl, CuI, Cu2S) и +2 [CuO, CuSO4 . 5H2O, Cu(NO3)2 . 6H2O, CuS, Cu2(OH)2CO3]; для серебра: +1 (Ag2O, AgNO3, AgCl, AgBr, AgI); для золота: +3 (AuCl3, H[AuCl4]). Как элементы 2-й группы медь, серебро и золото имеют по одному электрону на внешнем энергетическом уровне (ns 1 ), поэтому должны проявлять степень окисления +1. Характерная степень окисления, как у элементов 2-й группы должна быть +2. Для меди наиболее характерна степень окисления +2, для серебра +1, а для золота +3.
Уравнения взаимодействия KI с сульфатом меди
2Сu 2+ +2I — = Cu + + I2 0
Задание 404
Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом высшую степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Золото растворяется в «царской водке» с образованием комплекса H[AuCl4]
Au 0 +N 5+ = Au 3+ + N 2+
3Au + 12HCl + 3HNO3 = 3H[AuCl4] + 3NO + 6H2O
б) Золото растворяется в селеновой кислоте с образованием селената золота(III)
2Au 0 + 3Se 6+ = 2Au 3+ + 3Se 4+
Задание 428
Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления +4, а осмий — до+8.
Решение:
а) Реакция растворения платины в царской водке
3Pt 0 + 4N 5+ = 3Pt 4+ + 4N 2+
б) Реакция взаимодействия осмия с фтором:
🔍 Видео
Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Реакции ионов серебра с 15ю анионами и растворимость осадков/ Reactions of 15 anions with silver(+)Скачать

Реакция Концентрированной Серной Кислоты и Хлората Натрия. Реакция H2SO4 и NaClO3. Выделение ClO2.Скачать

ОВР с серной и азотной кислотами.Скачать
Качественная реакция ионов серебра с соляной кислотойСкачать

Серная кислота и ее соли. 9 класс.Скачать

Серебро + азотная кислота .Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

СЕРНАЯ КИСЛОТА | H2SO4 | Химические свойства разбавленной и концентрированной СЕРНОЙ КИСЛОТЫ | ХимияСкачать

Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать