Из предложенного перечня выберите все вещества, которые могут образоваться в результате щелочного гидролиза этилформиата.
1) муравьиная кислота
2) формиат калия
5) диэтиловый эфир
Запишите в поле ответа номера выбранных соединений.
Запишем уравнение гидролиза:
Соответственно, могут образоваться в результате щелочного гидролиза этилформиата формиат калия (2) и этанол (4).
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Урок 29. Сложные эфиры и другие
производные карбоновых кислот
В табл. 15 приведены соединения пяти различных классов – производные карбоновых кислот.
Производные карбоновых кислот
| Сложные эфиры |
|---|
кислот
кислот
кислот
кислот











Химические свойства производных карбоновых кислот
1. Гидролиз производных карбоновых кислот дает карбоновые кислоты:
2. Ангидриды и хлорангидриды кислот реагируют со спиртами с образованием сложных эфиров:
Задача 1. Какое производное кислоты:
а) быстро образует белый осадок, нерастворимый в НNO3, при добавлении спиртового раствора нитрата серебра;
б) реагирует с кипящим водным раствором NaOH, в результате реакции выделяется газ, окрашивающий бумажку красного лакмуса в синий цвет;
в) быстро реагирует с холодным раствором NaOH, высвобождая газ, который изменяет красную окраску лакмуса на синюю;
г) при гидролизе дает только карбоновую кислоту;
д) образует спирт при нагревании с кислотой или основанием?
Решение
а) Осадок со спиртовым растворов AgNO3 дают хлорангидриды кислот:
б) Газ, изменяющий красную окраску влажной лакмусовой бумажки на синюю, – это аммиак. С кипящим водным раствором NaOH выделяют газ аммиак азотсодержащие производные карбоновых кислот трех классов: 1) аммонийные соли RCOONH4; 2) амиды RC(O)NH2; 3) нитрилы RC
Уравнения реакций:
в) С холодным раствором NaOH быстро реагируют аммонийные соли карбоновых кислот (см. уравнение реакции б1).
г) Вещества, которые при гидролизе дают только карбоновые кислоты, – это ангидриды кислот:
д) Сложные эфиры RCOOR’ при нагревании с водной кислотой или основанием образуют спирты R’ОН:
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔍 ВидеоВсё про ГИДРОЛИЗ для ЕГЭ ПО ХИМИИ. с ЭКСПЕРИМЕНТАМИ!Скачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  ЩЕЛОЧНОЙ ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСкачать 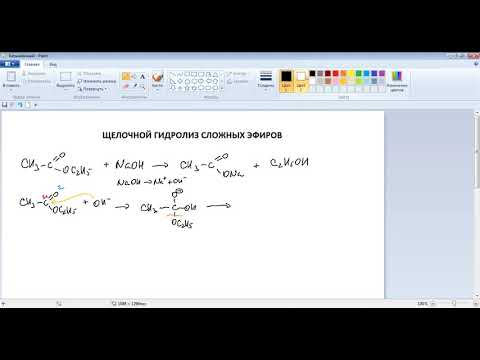 Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать  Гидролиз солейСкачать  11 класс. Гидролиз солей.Скачать  Гидролиз | Химия ЕГЭ | УмскулСкачать  Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать  Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать  Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать  Совместный гидролиз за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Гидролиз солей | ХимияСкачать  Гидролиз солей.ПримерыСкачать  Кислотный и щелочной гидролиз бинарных соединений | Химия ЕГЭ 2023 | УмскулСкачать  Совместный гидролиз в реакциях ионного обмена: за что?! | Химия ЕГЭ | УмскулСкачать  Гидролиз солей. Химия 9 классСкачать  |

















 (2,5-диметилфенола) = 1/2
(2,5-диметилфенола) = 1/2 СН3СН2СООН
СН3СН2СООН 




 •
• •V = 0,2•1,22•65,57 = 16,0 г.
•V = 0,2•1,22•65,57 = 16,0 г.




 .
.


