Когда разбивается ртутный термометр, многие сразу впадают в панику, и далеко не сразу нужно пользоваться марганцовкой, ибо ртуть сначала нужно грамотно убрать..
Ведь каждый знает, что пары ртути очень опасны для здоровья и могут вызвать серьезное отравление.
Первое, что вам нужно — это не паниковать.
Некоторые начинают пылесосить шарики (80Hg) ртути, убирать их тряпочкой или заметать веником.
Этого делать не стоит, особенно пылесосить.
Ведь пары ртути все ровно будут в воздухе и нанесут вред здоровью.
Быть может в некоторых случаях можно воспользоваться вызовом службы по демеркуризации, но это не всегда нужно..
- Что такое марганцовка!
- Что такое демеркуризация?
- Марганцовка
- Как проводить демеркуризацию ртути марганцовкой.
- Что делает марганцовка со ртутью?
- Возможно вы справитесь сами.
- Получение кислорода
- История открытия кислорода
- Способы получения и собирания кислорода в лаборатории
- 1) Разложение оксида ртути (II)
- 2) Разложение перманганата калия
- Разложение пероксида водорода
- Разложение хлората калия
- Разложение нитратов
- Получение кислорода в промышленности
- Как влияет марганцовка на ртуть?
- Как влияет марганцовка на ртуть?
- Что такое марганцовка?
- Как взаимодействует калия перманганат и ртуть?
- 🔥 Видео
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Что такое марганцовка!
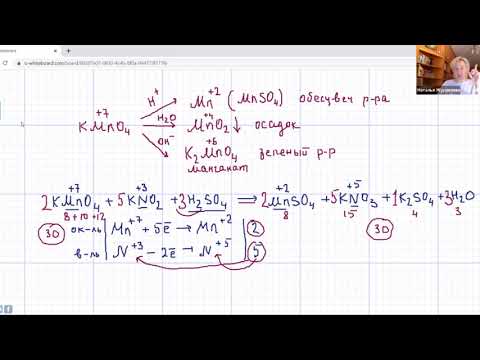
Перманганат калия (Kalii permanganas ) это марганцевая соль калиевой кислоты.
Химическая формула марганцовки KMnO4.
Это вещество является сильным окислителем.
А окисли́тели это вещества, в свойства атомов которого входят способности присоединять к себе во время химической реакции электроны.
Это наука и но с возможностью марганца доводить вещества до иных состояний не посолишь.
Например -был жидкий металл а стало солевое соединение.
Видео:Реакция этилена с раствором перманганата калияСкачать

Что такое демеркуризация?
Демеркуризация — это удаление ртути механическим и химическим методом при помощи других веществ.
Часто для этих целей используется обычная марганцовка.
Марганцовка, или перманганат калия ( калиевая соль) имеет формулу MnO⁴.
Как марганцовка действует на ртуть знает не каждый.
К сожалению она способна избавить вас только от атомарной ртути, но против капель она бессильна.
Некоторые пытаются провести этот демеркуризацию марганцовкой дома при отсутствии профессиональных демеркуризационных жидкостей.
Демеркуризация ртути полноценно марганцовкой в бытовых условиях невозможнпа.
Дело в том, что избавиться от ртути при помощи раствора марганцовки можно, лишь, с добавлением в калия перманганата (маргонцовку MnO⁴) соляной кислоты.
Обычный раствор марганцовки для полной демеркуризации не подойдет.
Это отностися к случаям, если жидкая ртуть попала на пол в большом количестве.
Все что получится при помощи очень крепкого раствора маргонцовки — несмываемые розовые пятна на напольном покрытии и мебели.
Видео:Окисление органических соединений перманганатом калияСкачать

Марганцовка
Видео:Получение кислорода из перманганата калияСкачать

Как проводить демеркуризацию ртути марганцовкой.
Если просто разбит градусник, и все крупные и мелкие шарики собраны, то можно провести процесс демеркуризации при помощи перманганата калия.
Это поможет снизить концентрации испаряющейся ртути.
Сначала нужно основательно собрать шарики металла с пола.
Делать это необходимо в спецодежде, или в рабочей форме, в старой одежде, которую потом можно утилизировать.
Для сбора можно использовать плотную бумагу или скотч.
- соберите все капли ртути,
- соедините в одну большую,
- перелейте металл в герметическую емкость.
Если ртуть попала в труднодоступные места, смочите в растворе марганцовки ватный тампон и соберите капли.
После проводится демеркуризации при помощи перманганата калия .
Видео:Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

Что делает марганцовка со ртутью?
Она нейтрализует вредное воздействие паров на живые организмы.
Она превращает атамарную ртуть в не летучее соединение.
Для этого процесса необходимо подготовить раствор марганцовки и протереть им поверхность, залить во все щели, куда могла попасть ртуть.
Дело в том, что марганцовка нейтрализует ртуть и уменьшает ее вредное воздействие на организм человека.
После проведенной химической дезинфекции необходимо сдать собранную ртуть в специальную лабораторию.
Выкидывать емкость на обычную свалку нельзя!
Видео:РТУТЬ, ОСТОРОЖНО!Скачать

Возможно вы справитесь сами.
Далеко не всегда нужен выезд специалиста.
Иногда есть возможность обойтись подручными средствами для демеркуризации ртути.
Если вам нужна профессианальная демеркуризация, заполняйте заявку и мы все подробно вам расскажем.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение кислорода
Видео:ОВР с перманганатом калия.Скачать
История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому. Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2H2O2 MnO2 → 2H2O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха.
Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип.
N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
Видео:Галилео. Эксперимент. Живая ртутьСкачать

Как влияет марганцовка на ртуть?
Видео:ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать

Как влияет марганцовка на ртуть?
Те, кто привык действовать по старинке и смывать любое опасное вещество подручными средствами, вряд ли хоть раз задумывались, как влияет марганцовка на ртуть. Вместе с тем, в сети можно найти множество советов о том, как поступить, если разбился градусник, и в них частенько фигурирует знакомый с детства розовый раствор, который еще пару десятилетий назад считался чуть ли не панацеей от всех болезней, начиная с кожных проблем и заканчивая ангиной и отравлениями. Впрочем, марганцовкой не только лечились, но и дезинфицировали поверхности от любого загрязнения. Так ли эффективно это средство при разбившемся градуснике и как влияет марганцовка на ртуть? Давайте развеем мифы!
Что такое марганцовка?
Прежде чем понять, как влияет марганцовка на ртуть, необходимо разобраться, что это за вещество. Марганцовка, или калия перманганат представляет собой темно-лиловые кристаллики, которые быстро растворяются в воде, окрашивая ее в приятный розово-фиолетовый оттенок различной интенсивности. Ее с давних времен используют в качестве антисептика, и этот подход в большинстве случаев оправдан. Правда, это полезное свойство не имеет никакого отношения к ртути: к сожалению, нейтрализовать частички ядовитого металла и уж тем более его пары не под силу даже самому концентрированному раствору марганцовки.
Как взаимодействует калия перманганат и ртуть?
Чтобы разобраться, как влияет марганцовка на ртуть, не требуется специального образования – достаточно школьного курса химии. Реакция между этими веществами – сложный процесс, который невозможен в бытовых условиях, и уж тем более при произвольном разведении кристалликов калия перманганата водой. Демеркуризация возможна только раствором калия перманганата с соляной кислотой.
« Метод основан на взаимодействии ртути со свободным хлором, образующимся при реакции перманганата калия с соляной кислотой. В результате образуется малотоксичная нерастворимая в воде каломель:
2KMnO4 + 16HCl = 2KCl + 2MnCI2 + 5Cl2 + 8H20;
2Hg + Cl2 = Hg2Cl2
Каломель, оставленная на воздухе, со временем разлагается с выделением металлической ртути, поэтому после демеркуризации обработанные поверхности обязательно промывают спец. раствором «- Источник
Поэтому, пытаясь провести самостоятельную демеркуризацию марганцовкой, вы лишь тратите свое время и подвергаете здоровье опасности. Все, к чему приведут подобные меры – несмываемые грязно-лиловые разводы на мебели, ковровом покрытии и других поверхностях, которые вам придется обработать. При этом частички ртути, вбившиеся в ткань или ворс обивки, под плинтусы и в щели, никуда не денутся – их необходимо нейтрализовать профессионально, иначе они будут загрязнять воздух в квартире. Поэтому лучше сразу обратиться в Эксперт-Ртути , чем рисковать собственным здоровьем и питать иллюзии относительно самостоятельных мер!
🔥 Видео
Разложение перманганата калия. Химический опытСкачать

Алюминий и РтутьСкачать

Химический эксперимент марганцовка и глицеринСкачать

Реакция НИТРАТА РТУТИ и ЭТИЛОВОГО СПИРТА. ФУЛЬМИНАТ РТУТИ. Опыты по химии. Домашние экспериментыСкачать

3.3. Алкины: Химические свойстваСкачать

Получение ХЛОРА. Реакция СОЛЯНОЙ КИСЛОТЫ и ПЕРМАНГАНАТА КАЛИЯ. Химические опыты. Chemical experimentСкачать

Механизм разложения оксида ртутиСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

