Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
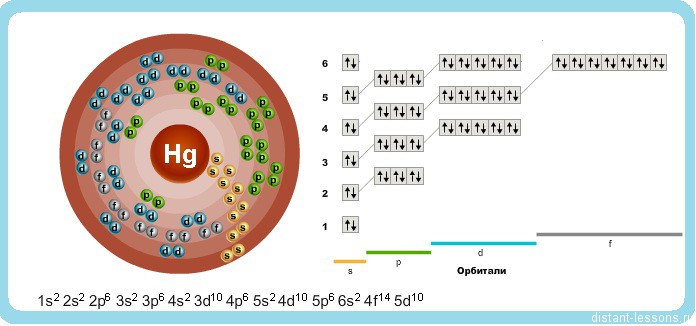
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
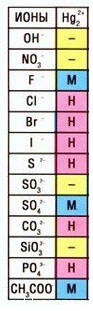
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Оксид — HgO (относят к слабым основным или даже амфотерным оксидам);Гидроксид — не выделен
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
- Ртуть
- Что такое ртуть
- Физические свойства ртути
- Химические свойства ртути
- Главные химические свойства ртути
- Ртуть в периодической таблице
- Воздействие ртути на окружающую среду
- Соли ртути
- Получение ртути
- Ртуть высокой чистоты
- Амальгама
- hg Меркурий или Ртуть
- Применение ртути
- Ртуть вопросы ответы?
- Похожие страницы:
- Leave a Comment
- Что нейтрализует ртуть? Раствор для демеркуризации ртути
- Жидкий металл
- Ртуть дома
- Такой привычный градусник
- Живое и ртуть
- Что происходит?
- Если это случилось
- Уборка разбитого ртутного градусника по шагам
- Что нейтрализует ртуть?
- Что лучше — хлорка или марганцовка?
- Для полного спокойствия
- 📸 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Ртуть
Ртуть это металл с уникальными свойствами который в нормальных условиях остается в жидком состоянии (расплавленном).
Известен с давних времен так как встречается в свободном состоянии и называется (меркурий), практически все соединения токсичны и ядовиты. Практическое применение его широко из за его свойств.
Это элемент с атомным номером 80 и атомной массой 200,59 г/моль. Это единственный жидкий металл. Ее символ-Hg.
Ртуть является хорошим проводником электричества и небольшим хорошим проводником тепла.
Благодаря наличию неспаренных электронов в d-орбитали элемента ртути, он является хорошим проводником электричества.
Видео:РТУТЬ, ОСТОРОЖНО!Скачать

Что такое ртуть
(Hydrargyrum), Hg — элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка, 12-й группе (устаревший хим. элемент II группы периодической системы элементов); ат. н. 80, ат. м. 200,59.
Серебристо-белый жидкий металл. В соединениях проявляет степени окисления +1 и +2.
Природная ртуть состоит из стабильных изотопов 198Hg, 198Hg, 199Hg, 200 Hg, 201Hg, 202Hg и 204Hg.
Получены 18 радиоактивных изотопов, из которых наибольшее практическое значение имеют изотопы 203Hg и 205Hg с периодами полураспада соответственно 47 дней и 5,1 мин.
Ртуть и ее соединения известны с древнейших времен . Содержание ртути в земной коре 8,3 х 10 -6 . Известно около 30 минералов ртути, включая ртуть самородную и амальгамы различных металлов.
Некоторые из минералов (киноварь HgS, ее разновидность метациннабарит, ливингстонит HgS х 2Sb2S3 и тиманнит HgTe) встречаются в сравнительно больших количествах и являются источником пром. добычи металла.
Кристаллическая решетка ромбоэдрическая, расстояние между атомами, равное постоянной решетки простейшего ромбоэдра, 2,999 А. Атомный радиус 1,60 А, ионный радиус Hg+ равен 1,12 А.
Ртуть — единственный металл , к-рый остается жидким при низких т-рах (вплоть до т-ры — 38,87° С).
Потенциалы ионизации Hg° → Hg+ → Hg2+ Hg3+ → Н4+ составляют соответственно 10,41; 18,55; 32,43 и 45,98 в.
Плотность ртути при т-рах 0 и 20° С равна соответственно 13,5951 и 13,5459 г/см 3 ; tкип 356,58° С; температурный коэфф. объемного расширения твердой ртути в интервале т-р от —89,9 до —39,5° С изменяется от 12,5 х 10 -5 до 17,1 х 10 -5 град-1.
Температурный коэфф. объемного расширения жидкой Р. в интервале т-р от —38,87 до 350° С изменяется от 1,823 х 10-4 до 1,889 х 10 -4 град-1; теплоемкость (кал/г- град): 0,0339 (т-ра —38,87° С); 0,03353 (т-ра 0° С); 0,03334 (т-ра 20° С); 0,03275 (т-ра 100° С) и 0,0324 (т-ра 350° С).
Удельное электрическое сопротивление (т-ры —30; 0 и 20° С) равно соответственно 0,91700; 0,94123 и 0,95833 ом-см. Металлическая Р. диамагнитна. Вязкость жидкой ртути (т-ра 20° С) 0,01544 г/см-сек, поверхностное натяжение 480 дин/см.
Интересный факт о ртути: еще недавно считали что если от очищенной ртути добиться твердого состояния, то ее можно будет превратить в золото.
Но еще больше они полагались на магические свойства этого вещества.
Например , жрецы Древнего Египта клали в деревянный или гранитный сосуд несколько граммов ртути и помещали его в горло мумии фараона — они считали, что после смерти это будет оберегать их правителя.
Ртутный пар при низких т-рах состоит в основном из атомов, с повышением т-ры степень ассоциации увеличивается, а при критической т-ре он почти целиком состоит из двухатомных молекул.
Давление насыщенных паров Р. (мм рт-ст.): 1,447 х 10 -8 (т-ра —70° С); 2,046 х 10 -4 (т-ра 0° С);1,2979 х 10 -3 (т-ра 20° С) и 1,3394 х 10 -2 (т-ра 50° С).
Твердую ртуть , как и свинец, можно ковать, протягивать через фильеры, резать ножом и т. д. Твердость по Моосу замерзшей Р.— 1,5.
Сжимаемость жидкой Р. (т-ра 30° С, давление от 1 до 50 бар) 4,051 х 10 -6 бар , коэфф. сжимаемости твердой альфа-ртути (т-ра —73° С, норм, давление) 3,52 X 10 ат-1.
При невысоких т-рах Р. инертна ко многим агрессивным жидкостям и газам, включая кислород воздуха.
Она практически не взаимодействует с концентрированной серной и соляной к-тами, но хорошо растворяется в азотной к-те, «царской водке», в горячей концентрированной серной к-те.
Физические свойства ртути
Ртуть-блестящий серебристый жидкий металл.
Плотность ртути составляет 13,6 г на кубический сантиметр при температуре 20 градусов Цельсия.
Температура кипения ртути очень высока-356,6 градуса Цельсия.
Электронная конфигурация 4f 14 5d 10 6s 2 .
3 энтальпии ионизации ртути составляют 1004 кДж/моль, 1796 кДж/моль, 3294 кДж/моль соответственно. Приращение наблюдается в энтальпии ионизации ртути. Третья энтальпия ионизации ртути является самой высокой. Это связано с дополнительной стабильностью заполненных d-орбиталей.
Поверхностное натяжение металла ртути очень велико.
Известно что при эксгумации тела Ивана Грозного ученые определили, что содержание ртути в организме царя в 5 раз превышало допустимые нормы.
Химические свойства ртути
Ртуть при обычных условиях существует в жидком состоянии. Вступает в сплав с другими металлами образуя амальгаму.
Жидкая ртуть устойчива на воздухе и в воде , хотя и не покрыта защитной оксидной плёнкой . Эти свойства ртути находятся в соответствии с её высокой ионизационным потенциалом .
Hg , стоящая в ряду напряжений правее водорода , растворяется только в концентрированной азотной и горячей концентрированной серной кислотах , образуя соответствующие соли :
При действии на избыток ртути разбавленной азотной кислоты образуется нитрат ртути ( I ) :
Атомы ртути ( в отличие от цинка и кадмия ) могут связываться друг с другом ковалентной связью , образуя группировку Hg : Hg · .
Каждый атом ртути в этом комплексе имеет степень окисления 1+ . Окислители легко повышают степень окисления ртути :
а восстановители переводят Hg⁺ в Hg⁺² и далее в металлическую ртуть ;
Гидроксиды ртути весьма не стабильны и разлагаются уже в ходе реакции :
Нагревание приводит к восстановлению до свободного металла:
Все соединения ртути чрезвычайно ядовиты, а в случае если ртуть была разлита её можно связать (нейтрализовать ) с серой.
Поэтому места , где разлита ртуть , посыпают порошком серы или для « демеркурирования » также применяют раствор хлорида железа FeCl3.
При нагревании на воздухе окисляется . Если в ртути есть примеси свинца, цинка, меди, кадмия и др., поверхность ее покрывается серой пленкой окислов.
С кислородом ртуть образует окись HgO, имеющую красную и желтую кристаллические модификации, с галогенами — соединения типа Hg2Г2 и HgГ2 (где Г — фтор, хлор, бром и йод).
Наибольшее значение имеют хлориды ртути: Hg2Cl2 — каломель — белые кристаллы, мало растворимые в воде, а также HgCl2 — сулема — бесцветные кристаллы, растворимые в воде.
При взаимодействии ртути с серой образуется сульфид HgS , известный в трех модификациях: альфа-киноварь — красная, метациннабарит — черная и бета-киноварь.
Метациннабарит и бета-киноварь неустойчивы и со временем переходят в обыкновенную киноварь.
Главные химические свойства ртути
Ртуть является менее реакционноспособным металлом.
Не вступает в реакцию с кислородом, присутствующим в воздухе.
Ртуть реагирует с некоторыми кислотами.
Ртуть можно растворять в царской водке и концентрированной азотной кислоте.
Ртуть вступает в реакцию с серой.
Ртуть в периодической таблице
Символ ртути Hg происходит от греческого слова для ртути, которое является Hydrargyrum. Значение этого слова-жидкое серебро, так как оно имеет цвет и блеск серебра, но в жидком состоянии.
Ртуть-единственный жидкий металл, который существует.
Металл ртуть был открыт древними людьми.
Ртуть это элемент, который нельзя приготовить или уничтожить . Единственным источником ртути являются ее руды в земле.
Ртуть очень токсична, и с ней следует обращаться осторожно. Она опасна для окружающей среды и рабочего места.
Ртуть может проникать в пищевую цепь и проявляет явление биологического увеличения. Классическим примером этого является болезнь Минамата в Японии, которая была вызвана употреблением в пищу рыб пруда, вода которого была загрязнена металлической ртутью.
Ртуть также известна как ртуть, потому что она быстро движется при заливке. Он получил свое название от быстро движущейся планеты Меркурий.
Это тяжелый металл и образует определенные соединения, которые не поддаются биологическому разложению, поэтому накапливаются в окружающей среде.
Сплавы ртути с другими металлами, такими как олово, золото и т. д., Известны как амальгамы.
Сульфидная руда ртути-киноварь.
Воздействие ртути на окружающую среду
Ртуть превращается в метилртуть некоторыми микроорганизмами. Метилртуть это соединение, которое растворимо в воде и легко усваивается живыми организмами. Таким образом ртуть попадает в пищевую цепь и влияет на различные организмы. Это приводит к гибели многих организмов, что нарушает баланс природы.
Соединения ртути не поддаются биологическому разложению и накапливаются в окружающей среде. Накопление такого токсичного тяжелого металла крайне опасно для экосистемы.
Соли ртути

Нитрат окиси Hg(NО3)2 — расплывающиеся на воздухе желтовато-белые кристаллы. Сульфат закиси Hg2SО4 — белые или бесцветные кристаллы, сульфат окиси HgSО4 — бесцветные кристаллы.
Растворением окиси HgO в растворе синильной к-ты, а также взаимодействием щелочного цианида и соли двухвалентной Р. получают бесцветные кристаллы цианида Hg(CN)2.
При нагревании смеси ртути, концентрированной азотной к-ты и спирта образуется цианат Hg(CNO)2 — гремучая ртуть — белые кристаллы, взрывающиеся при ударе.
Взаимодействуя с металлами, Р. образует амальгамы.
Известно большое количество ртуть-органических соединений, в к-рых атомы Р. непосредственно связаны с атомами углерода.
Эти соединения находят применение в органическом синтезе при получении элементоорганических соединений.
Получение ртути
В пром-сти металлическую ртуть получают гл. обр. пирометаллургическим способом — окислительным обжигом ртутных руд или их концентратов при т-ре 700— 800° С в пламенных, трубчатых, многоподовых и муфельных печах, а также в печах кипящего слоя.
При обжиге руды, содержащей, напр., киноварь, Р. восстанавливается до металла, и ее пары вместе с сернистым газом, образующимся при разложении сульфида, попадают в конденсационную систему, где смесь газов охлаждается, пары ртути конденсируются и стекает в приемники.
Для определения ртути в его соединениях используют качественную реакцию на ртуть.
Для получения металла гидрометаллургическим способом сырье, содержащее металл в виде сульфида, вначале обрабатывают водным раствором сульфида натрия и едкого натра.
Получающийся при этом водный раствор соединения HgS х Na2S цементируют алюминием или подвергают электролизу; выделившуюся Р. фильтруют и затем перегоняют в вакууме.
Весьма перспективен способ получения ртути, основанный на обжиге ртутного сырья в вакууме.
В лабораторных условиях ртуть очищают от примесей следующим образом, нитрат ртути в месте с азотной кислотой пропускают через фильтр.
Фильтр удаляет механические примеси, а азотная кислота растворяет другие металлы, далее ртуть восстанавливают.
Ртуть высокой чистоты
Ртуть высоких марок чистоты, а также сверхчистая ртуть может быть получена при комплексном использовании спец. хим. очистки, перегонки под пониженным давлением воздуха.
Электролитическим рафинированием в электролизерах с биполярными электродами и последующим перегревом паров ртути выше т-ры 1000° С.
Металлическую ртуть используют в химии, металлургии, энергетике, электро- и радиотехнике, в приборостроении, строительном деле и др.
В хим. пром-сти ртутные катоды применяют для электрохим. получения едкого натра и хлора, а также многочисленных органических соединений.
Амальгама
Способность ртути образовывать амальгамы используют для комплексной переработки полиметаллического сырья методами амальгамной металлургии.
Для получения высокодисперсных металлических порошков, многокомпонентных сплавов заданных составов, чистых и сверхчистых металлов, содержание примесей в к-рых не превышает 10—6—10-8%.
В энергетике ртуть используют как рабочее тело в мощных бинарных установках пром. типа, где для генерации электро энергии на первых ступенях применяют ртутно-паровые турбины, а на второй — турбины, работающие на водяном паре.
Кроме того, ртуть используют в ядерных реакторах для отвода тепла.
Пары применяют в люминесцентных лампах дневного света, а также в ртутных кварцевых лампах низкого, высокого и сверхвысокого давления.
Помимо этого, пары используют в газотронах, газонаполненных тиратронах и триодах. Особенно широко используют ртути в вакуумной технике.
Ртутные диффузионные насосы незаменимы при получении сверхвысокого (порядка 10-13 мм рт. ст.) вакуума.
В лабораторной практике ртуть применяют в барометрах, манометрах, вакуумметрах, термометрах, затворах, прерывателях, высоковакуумных насосах, всевозможных реле, терморегулирующих устройствах.
Ее используют в качестве балластной, термостатирую-щей и уплотняющей жидкости. Р. нашла применение в полярографическом анализе.
Ртуть и амальгамы используют при амперометрическом и потенциометрическом титровании, кулонометрическом анализе. С помощью ртути определяют пористость материалов.
hg Меркурий или Ртуть
Единственный металл , находящийся при обычной температуре в жидком состоянии (температура плавления ртути -38,8°C ) .
Она имеет белый цвет и обладает меньшей восстановительной активностью чем цинк . В ряду напряжений ртуть расположена правее водорода , то есть не вытесняет не вытесняет его из воды и кислот .
Радиус атома ртути почти равен радиусу атому кадмия , а заряд ядра атома значительно больше , поэтому электроны внешнего слоя удерживаются ртутью значительно прочнее .
Природная ртуть состоит из смеси семи изотопов : 196Hg ( распространён 0,155% ) , 198Hg ( 10,04% ) , 199Hg ( 16,94% ) , 200Hg ( 23,14% ) , 201Hg ( 13,17% ) , 202Hg ( 29,74% ) , 204Hg ( 6,82% ) , так же были получены радиоактивные изотопы ртути с массовыми числами 171—210.
Ртуть легко образует с другими металлами сплавы , которые называются амальгамами , например с натрий Na , калий K , серебро Ag , золото Au , платина Pt , цинк Zn , кадмий Cd , олово Sn , свинец Pb образуя с ними жидкие и твердые сплавы.
В недавнем прошлом с помощью ртути получали золото , серебро , а реакции называется амальгамация золота и амальгамация серебра . Также на этой основе лежит покрытие металлических предметов золотом.
Hg химически малоактивна и на воздухе без изменений может хранится длительное время . Однако при длительном слабом нагревании может окислятся , образуя окись ртути :
При растирании в ступке ртуть очень легко взаимодействует с серой , образуя сульфид ртути ( II ) чёрного цвета :
С водой ртуть в реакцию не вступает , но хорошо реагирует с азотной кислотой и концентрированной серной кислотой , обладающие сильными окисляющими действиями.
При этом в зависимости от того , при какой температуре ведётся реакция , образуются соли как одновалентные , так и двухвалентной ртути.
Соединения как одновалентной , так и двухвалентной ртути достаточно устойчивы , хотя и могут превращаться друг в друга.
Ртуть сильно ядовита , которая даже при комнатной температуре легко испаряется и может вызвать тяжёлые отравления , оказывающие сильное влияние на сердце.
При попадании соединений ртути внутрь возникает расстройство деятельности органов пищеварения и почек . Очень ядовиты и соединения ртути , такие как сулема.
Применение ртути
В промышленности применяется она как металл так и некоторые его соли.
Металлическую ртуть используют при изготовлении термометров , барометров , в некоторых измерительных приборах.
А также при добыче золота для его очистке от примесей , так как ртуть легко образует амальгамы с золотом и другими некоторыми благородными металлами.
Так же использовалась в зубоврачебной практике для изготовления пломб.
Применение в медицине в качестве добавления в крема для борьбы со вшами.
Соли ртути также находят некоторое применение такие как сулема HgCl2 используется как дезинфицирующее средство но в последнее время предпочтение другим дез. средствам , каломель Hg2Cl2 ( Cl — Hg — Hg — Cl ) применялось как лёгкое слабительное.
В природе ртуть встречается изредка в самородном жидком состоянии , но в виде соединений , например киновари HgS . Для получения из неё ртути киноварь сначала обжигают :
а затем полученную окись ртути HgO разлагают нагреванием :
Обычно обе реакции протекают одновременно в едином процессе , такими же свойствами обладает оксид серебра при нагревании он восстанавливается до свободного состояния.
Ртуть применяют также для точной калибровки мерной посуды, для определения диаметров капиллярных трубок.
Широкое применение находят также соединения металла: напр.,окись HgO используют в качестве окислителя, для изготовления красок.
Искусственный сульфид HgS — составная часть люминофоров на основе сульфида кадмия и катализаторов в органическом синтезе.
Ртуть вопросы ответы?
Каковы области применения ртути?
- Существуют различные области применения металлической ртути в различных секторах-
- Ртуть используется в термометрах для измерения температуры тел и предметов.
- Вермиллион-сульфид ртути.
- Некоторые соединения ртути используются во взрывчатых веществах.
- Хлорид ртути используется в медицине.
- Различные соединения ртути используются в качестве мази для кожи.
- Некоторые соединения ртути также используются в качестве инсектицидов и родентицидов.
- Металлическая ртуть используется для изготовления батарей, ламп и люминесцентных ламп.
- Кроме термометров ртуть также используется в барометрах, манометрах, сфигмоманометрах (прибор, используемый для измерения артериального давления).
- Ртуть также используется в качестве катализатора во многих реакциях.
- Ртуть также используется в процессе добычи золота.
Воздействие ртути на здоровье и окружающую среду?
Воздействие ртути на здоровье человека
Если ртуть расщепляется из разбитых термометров, она может попасть в организм через вдыхание, так как это летучий металл, или через кожу и может вызвать различные заболевания в организме, если присутствует в большом количестве.
Ртуть является высокотоксичным металлом и может вызывать раздражение кожи, кожные высыпания, аллергические реакции.
Она может вызывать головные боли, может повредить нервную систему организма.
Он может вызывать генетические деформации и изменения в генетическом материале человека.
Она также может негативно влиять на репродуктивное здоровье.
Другие неблагоприятные последствия ртути включают изменения зрения, потерю памяти, повреждение мышц и нарушение координации мышц.
Можно ли уничтожить ртуть?
Ртуть является элементом, который нельзя уничтожить; поэтому, ртуть, уже находящуюся в пользовании, можно повторно использовать в других важных областях без дальнейшей необходимости добычи ртути.
Как собрать ртуть с пола домашних условиях?
Необходимо обработать поверхность, на которой разлилась ртуть, 0,2 % раствором (2 г на 1 л воды) перманганата калия, что удобно сделать распылителем.
Через день после проветривания промыть концентрированным раствором соды в мыльной воде.
Статья на тему Ртуть
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Что нейтрализует ртуть? Раствор для демеркуризации ртути
Несмотря на то что медицинские технологии постоянно развиваются и электронные приборы медицинского назначения успешно используются в домашних условиях, ртутный градусник для измерения температуры тела остается по-прежнему наиболее часто встречающимся домашним подспорьем. Случается, что градусник бьется, и тогда возникает два вопроса: «Как убрать содержимое градусника?» и «Что нейтрализует ртуть?»
Видео:Йодид Ртути(1) - Hg2I2. Реакция Ртути И спиртового раствора Йода. Реакция Hg и I2.Скачать

Жидкий металл
С детства все знают, что металл — это что-то прочное, твердое, блестящее. Определение химическим элементам, относящимся к группе металлов, дал еще Михайло Ломоносов два с половиной столетия назад. Но, как всегда практически и бывает, каждое правило имеет свои исключения. Вот и металлы не всегда выглядят так, как по определению великого русского ученого должны выглядеть. Вот ртуть. Это металл, занимающий 80-ю ячейку таблицы химических элементов, разработанной великим ученым-химиком Д. И. Менделеевым. Но в привычных для людей условиях ртуть — не твердое вещество, это жидкость. И это единственный жидкий металл из всех, которые известны науке на сегодняшний день.
Об удивительных свойствах этого химического элемента можно говорить довольно много. Но именно благодаря своим качествам ртуть — особый химический элемент. Где применяется ртуть в современной промышленности, проявляя свои характерные особенности? Таких отраслей много — от известного всем медицинского термометра до атомно-водородной энергетики.
Видео:Химические свойства кислорода. Урок 18. Химия 7 класс.Скачать

Ртуть дома
Международным сообществом ртуть признана одним из самых агрессивных веществ, загрязняющих природу. Но без этого химического элемента невозможно представить многие сферы жизнедеятельности человека. Дома наверняка у многих есть градусники, где индикатором температуры выступает столбик ртути, лампы люминесцентные, колбы которых наполнены парами ртути в смеси с инертным газом аргоном, некоторые аккумуляторы в мобильных телефонах. Сами по себе эти предметы не опасны, а необходимы и полезны. Но при повреждении они могут стать причиной серьезных проблем со здоровьем всех домашних. Единственный вопрос, который следует задать, если дома вдруг появился разбитый градусник: «Что делать?»
Видео:Воздух. Состав воздуха. 7 класс.Скачать

Такой привычный градусник
Со стеклянными градусниками с наполненной ртутью тонкой вакуумной колбой — капилляром, и шкалой делений все знакомы с самого детства. Это самый привычный и необходимый медицинский прибор в любой семье. Да, сейчас можно купить электронные градусники самых разных форм — от предназначенного для грудничков в виде соски до бесконтактного. Но все же абсолютное большинство людей считают именно ртутные термометры самыми точными и практичными. Вот только о таящейся в градуснике опасности задумываются немногие.
Зачем, казалось бы, нужно было придумывать ртутный термометр, если вещество, помогающее измерять температуру тела, очень опасно? Но именно ртуть стала той жидкостью, которая удовлетворяет потребностям точного измерения температуры, равномерно расширяясь при ее увеличении, поднимаясь вверх по капилляру термометра. Изобретен ртутный термометр был в 18 веке, как улучшенный вариант спиртового термометра. В нашей стране принята для отсчета температуры шкала Цельсия, в странах Запада и в Америке температуру измеряют по Фаренгейту. Используя ртутный термометр в домашних условиях, мало кто задумывается над ответом на вопрос «что нейтрализует ртуть», если вдруг градусник разобьется.
Видео:Кислород. Способы собирания газов. Урок 16. Химия 7 класс.Скачать

Живое и ртуть
Человечеству ртуть известна с древних времен. Красивые, алые на разломе камни киновари — природного ртутного минерала, люди добывали, чтобы получить яркую краску, не зря камень в переводе с древнеперсидского называется «кровь дракона». И уже тогда ртуть использовали для амальгамирования — одного из способов очистки золота. Тогда же было известно о ядовитых свойствах соединений ртути, например сулемы, которая и по сегодняшний день используется в качестве дезинфицирующего средства. Ртуть — уникальный металл, она начинает плавиться при температуре приблизительно -39 градусов по шкале Цельсия. Все наслышаны, что она очень ядовита. Чем опасна для человека ртуть из разбившегося градусника, нужно уточнить.
Если ртуть попадает на открытый воздух, она начинает испаряться, как вода, причем активное испарение начинается уже при 18 градусах Цельсия. Пары ртути насыщают воздух помещения, особенно если оно не проветривается. И такой воздух становится опасным и для человека, и для домашних животных, и даже для комнатных растений и рыбок в аквариуме. Особенностью этого химического элемента является то, что он способен аккумулировать, то есть накапливаться, в живом организме, а вывести его практически невозможно. Ртуть копится, пока не наступит критический предел ее концентрации в организме. Причем на первых этапах такого отравления симптомы настолько слабо выражены, что их можно принять за усталость, легкую простуду, но никак не за серьезную проблему со здоровьем, опасную для жизни.
Видео:Разложение роданида ртути (decomposition of mercury(II) thiocyanate)Скачать

Что происходит?
Ртуть опасна для всего живого, она нарушает обменные процессы, человек чувствует поначалу слабость и апатию, которые с течением времени перерастают в нарушения работы всех органов: почки, печень, сердце, легкие страдают от избытка ртути в организме. Летальный исход может иметь причиной отравление ртутью из градусника. Симптомы и последствия вдыхания ртутных паров или, что еще хуже, попадания ртути в организм человека через рот могут быть очень страшны.
Отравление ртутью, как и любыми другими токсичными и опасными веществами, может быть острым, а может быть хроническим. Острое отравление характеризуется головной болью, рвотой и слюнотечением, болью в горле и в животе, набуханием и кровоточивостью десен, может повышаться температура тела. Острое отравление проявляется примерно через 2 часа после значительной дозы ртути, попавшей в организм.
Хроническое отравление — результат длительного вдыхания паров ртути в малых концентрациях. Оно часто развивается у тех людей, в жилище которых когда-то был разбит ртутный термометр, но уборка и нейтрализация вещества не были проведены так, как это следовало бы сделать.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Если это случилось
Разбитый термометр — это, казалось бы, такая мелочь. Нужно просто собрать осколки, убрать ртутные шарики, ну еще пол помыть. Но все совсем не так. Разбившийся ртутный градусник — это серьезная опасность для всех домашних. Отравление парами ртути начинается, как только это вещество из запаянной стеклянной колбы попадает на открытый воздух. Вопрос о том, что нейтрализует ртуть, отходит на второй план, уступая место вопросу о том, как ее собрать. Начинается подметание, подключается пылесос, влажные тряпки. Но то, чем люди обычно наводят уборку, использовать категорически запрещено, убирая разбившийся градусник.
Ртуть — жидкость, и собрать ее, допустим, как пластилин, в шарик не получится, и сухими тряпками вытереть ее тоже невозможно. От удара, который разбивает капсулу градусника, вещество распадается на мельчайшие частицы, разлетающиеся по комнате. Работа веником только усугубляет ситуацию, так как веточки сорго или синтетические щетинки дробят ртутные шарики на еще более мелкие части. Не поможет и пылесос, так как, с одной стороны, он убирает ртуть, а с другой, вместе с отработанным воздухом в виде мельчайшей пыли отправляет обратно по всей комнате, к тому же убиравший ртуть пылесос придется затем утилизировать, ведь очистить его от мельчайших частиц ртути, забившихся во все детали, не получится.
Мокрыми тряпками ртуть не убрать, а частицы вещества, начавшего свою отравляющую работу, могут попасть в щели пола, в шерстяные волокна ковра. Если в комнате, где разбился градусник, есть на полу ковер или палас, то их проще утилизировать, завернув в плотный полиэтиленовый пакет и убрав из комнаты. А вот с пола ртутные шарики удобнее всего убирать при помощи обычной медицинской груши, собирая ртуть в стеклянную банку.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Уборка разбитого ртутного градусника по шагам
Если есть разбитый градусник, что делать? Ответ на этот вопрос будет состоять из следующих рекомендаций:
- Вывести из комнаты, а лучше и из квартиры, всех домочадцев, включая животных, на прогулку, пока уборка не будет закончена.
- Закрыть дверь комнаты.
- Открыть все окна настежь. Приток холодного воздуха сдержит активное испарение ртути и будет уменьшать ее концентрацию.
- Надеть медицинскую маску, а лучше респиратор, и резиновые перчатки, переодеться в одежду, с которой не жалко будет расстаться после уборки.
- Приготовить медицинскую грушу — спринцовку, стеклянную банку с плотно закручивающейся крышкой, марганцовку или хлорку, холодную воду.
- Включить яркое освещение, так как ртуть — блестящий металл, и ее будет хорошо видно при ярком свете.
- Шарики ртути удобнее всего собирать, засасывая их при помощи спринцовки и опуская в банку; этим медицинским предметом проще выудить ртуть из щелей в полу и под плинтусами. Встречаются рекомендации по уборке ртути металлической проволокой, листами бумаги, но ртуть постоянно скатывается и рассыпается на мелкие капельки при малейшем неосторожном движении, поэтому удобнее спринцовки в домашних условиях нет ничего.
- После того как ртуть собрана, место, где был разбит градусник, нужно обработать концентрированным раствором дезинфицирующих средств — марганцовки или хлорки, разведя их холодной водой.
- Банку с собранной ртутью, спринцовку, осколки разбитого градусника, марлевую повязку, респиратор, одежду нужно отнести в СЭС, где их обязаны принять на утилизацию. Выкидывать на помойку эти предметы ни в коем случае нельзя.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Что нейтрализует ртуть?
Ртуть — опасное для живого вещество. Оно относится к 1 классу опасности в соответствии с нормативным документом — ГОСТом 17.4.1.02-83. Раствор для демеркуризации ртути в промышленных масштабах — это порошок серы. Он вступает с металлом в химическую реакцию, превращая его в нелетучее соединение — сульфид ртути. Это вещество уже достаточно просто убрать, так как оно твердое, в отличие от самого жидкого металла, норовящего разлететься от любого прикосновения на мелкие шарики.
В домашних же условиях редко найдется порошок серы для уборки разбившегося ртутного градусника. Но ртуть и марганцовка, или ртуть и хлорсодержащие моющие средства позволят нейтрализовать вредный жидкий металл. Да, лучше всего сначала убрать ртуть как можно тщательнее, а затем обработать хлоркой или марганцовкой все поверхности в комнате. Пол можно просто залить концентрированным раствором хлорсодержащего моющего средства, например для дезинфекции унитазов. Повторную уборку «начисто» лучше всего провести через сутки.
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Что лучше — хлорка или марганцовка?
Это только в фильмах-катастрофах или экшн-сказках появляется герой, который всех спасает и избавляет от неминуемой гибели. В жизни при любых критических ситуациях лучше все делать самому и тщательно, не рассчитывая на помощь извне, потому что только в крупных городах есть службы, профессионально занимающиеся утилизацией домашних бытовых проблемных отходов и уборкой помещений в соответствии с возникшей опасностью. Чтобы самостоятельно избавиться от опасных последствий разбившегося градусника, лучше всего использовать подручные средства не менее эффективные, чем средства специалистов.
Нейтрализовать остатки ртути можно марганцовкой или хлоркой. Растворы должны быть концентрированными, а значит, достаточно едкими. В 1 литр раствора марганцовки следует влить 1 столовую ложку уксусной эссенции и добавить 1 столовую ложку обычной соли. Марганцовка для уборки будет иметь практически черный оттенок, и она обязательно оставит несмываемые следы на поверхности пола. Удобнее и проще использовать хлорсодержащие средства для уборки и дезинфекции дома, ту же «Белизну» например. Этим средством обрабатывают поверхность после ртути в течение 15 минут, затем промывая чистой водой. Такую уборку следует повторять как можно чаще в течение 2-3 недель.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Для полного спокойствия
Итак, ртутный термометр все-таки разбился. Но демеркуризация проведена правильно, тщательно, все опасные вещи утилизированы по правилам в специальную организацию, занимающуюся подобными проблемами. И чтобы успокоить себя и своих домашних, для проверки результата можно использовать специальный анализатор паров ртути. Он представляет собой тестовые полоски, которые при взаимодействии с парами ртути изменяют окраску. Это более дешевый и доступный способ проверить безопасность помещения, чем вызывать специалистов для проведения подобного обследования дома. Инструкция по использованию тест-полосок прилагается к каждому комплекту анализатора, а приобрести его можно в специализированных магазинах.
📸 Видео
Реакция НИТРАТА РТУТИ и ЭТИЛОВОГО СПИРТА. ФУЛЬМИНАТ РТУТИ. Опыты по химии. Домашние экспериментыСкачать

Этот Металл ВЕДЕТ СЕБЯ ОЧЕНЬ СТРАННО!Скачать

Разложение ЙОДИДА РТУТИ HgI2. Получение РТУТИ. Опыты по химии дома. Decomposition of MERCURY IODIDE.Скачать

Состав воздухаСкачать

Получение ЙОДИДА РТУТИ HgI2. Реакция РТУТИ и ЙОДА. Опыты по химии.Chemical experiment.Mercury iodideСкачать

РТУТЬ. Анализ на содержание. Химия – ПростоСкачать

Алюминий вступает в реакцию с ртутью.Скачать