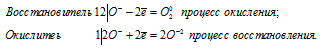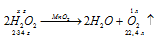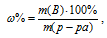Разложение пероксида водорода это процесс разделения молекулы пероксида водорода на воду и кислород, так как концентрированная перекись непрочное соединение, уже при комнатной температуре на свету разлагается по реакции (формула разложения пероксида водорода):
Реакция ускоряется со прикосновением с катализаторами ( MnO2 , PbO2 и другие ).
- Каталитическое разложение пероксида водорода
- Лабораторное разложение перекиси водорода
- Активность катализатора
- Опыт разложение пероксида водорода
- Физические свойства пероксида водорода Н2О2
- Можно ли получить перекись водорода из водорода и кислорода
- Похожие страницы:
- Leave a Comment
- Допишите уравнение реакции разложения пероксида водорода и расставьте необходимые коэффициенты: H2O2 = … + …
- Получение, строение и свойства пероксида водорода
- 📹 Видео
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Каталитическое разложение пероксида водорода
Пероксид водорода весьма удобный объект для иллюстрации каталитического процесса, влияния различных катализаторов на скорость химической реакции.
Измерение объема кислорода, выделяющегося при разложении пероксида водорода, позволяет проводить этот опыт количественно, притом с достаточной степенью точности.
Активные вещества которые участвуют в интенсивном распаде молекулы пероксида водорода являются металлы переменной валентности (Fe, Сu, Мn, Со, Сr) и их соли.
Разложение пероксида водорода катализаторами сводится к увеличению электролитической диссоциации пероксида водорода, что содействует образованию свободного гидроксид – иона и ускорению распада пероксида водорода.
Разложение пероксида водорода обратимая или нет.
Экспериментально доказано, что добавление к перекиси катализатора приводит к полному разложения молекулы пероксида водорода на воду и кислород. Процесс разложения на прямую зависит от температуры вещества.
А также какой катализатор добавлен, также установлено, что на каталитический процесс разложения влияет добавление некоторых кислот и зависимость концентрации перекиси.
Лабораторное разложение перекиси водорода

То, что было осуществлено в науке химии как нечто новое, может быть повторено на внеурочных и факультативных занятиях как интересные ученические исследования.
Pис. 2 Установка для количественного опыта разложения пероксида водорода:
1-колба для перегонки, 2 — пробирка с катализатором. 3 — чаша кристаллизационная, 4 — эвдиометр.
Во время проведения демонстрационных экспериментов следует знать о пероксиде водорода (обычно 3%-ном) как о веществе, которое подвергается бурному разложению под действием различных катализаторов.
С этой целью в демонстрационные пробирки приливают по 30 мл раствора пероксида водорода и в каждый вносят одно из следующих веществ: оксид марганца (IV), оксид железа (III), активированный уголь, раствор перманганата калия, раствор хлорида железа (III), раствор дихромата калия, кусочек сырого мяса, содержащий фермент каталазу, находящуюся обычно в крови млекопитающих и человека.
Наблюдают за выделением пузырьков газа. Выделение кислорода подтверждают тлеющей лучинкой. Демонстрационные пробирки размещают в штативе с подсветом.
Количественный опыт каталитического разложения пероксида водорода может быть осуществлен в установке, показанной на рисунке 2.
Для собирания газа можно использовать промышленный эвдиометр, имеющий градуировку. Различную скорость образования кислорода можно наблюдать в приборе, описание которого дано В. С. Полосиным, с использованием двух медицинских шприцев, а также с помощью установки для проецирования опытов на экран.
Активность катализатора

Рис. 3. Определение активности различных катализаторов:
1 — пробирка с пероксидом водорода, 2 — колба с катализатором, 3 — стеклянная трубка с пробкой, 4 — Г образная газоотводная трубка, 5 — колба с водой, 6 — сифон, 7 — стакан с водой, 8 — зажимы.
Опыт разложение пероксида водорода
Рекомендуется проводить опыты в следующей последовательности:
- Проверяют герметичность прибора (рис. 3), для чего закрывают пробки и открывают зажимы 8: вода не должна вытекать в стакан.
- В пробирку 1 наливают 5 мл пероксида водорода (30%-ного) и перекрывают резиновую трубку зажимом 8.
- В колбу 2 вносят катализатор и вставляют в нее трубку 3, соединенную с пробиркой 1.
- Выравнивают давление внутри прибора с атмосферным давлением. С этой целью открывают зажим 8 сифона 6 и поднимают стакан 7 с водой так, чтобы вода в нем и в колбе находилась на одинаковом уровне, и затем снова закрывают зажим.
- Воду выливают из стакана и наливают в него точный ее объем — 100 мл, предварительно отмерив его мензуркой.
- Опускают кончик сифона 6 в стакан 7 с водой.
- Открывают оба зажима 8 на приборе и быстро вливают пероксид водорода в колбу 2 с катализатором.
- Через 3 мин вновь приводят давление внутри прибора к атмосферному давлению.
- Закрывают зажим сифона 6 и измеряют объем воды, вытесненной в стакан кислородом.
- Из измеренного объема воды вычитают 100 мл, т. е. объем воды, ранее добавленной в стакан.
По количеству выделившегося кислорода располагают испытанные катализаторы в порядке возрастания их каталитической активности.
Физические свойства пероксида водорода Н2О2
Сильный окислитель. Мол. массе 34,01; коэф. рефр. 1,4067 при 25 °С; плотн. 1448 кг/м3; т. кил 69,7 °С при 3,72 кПа и 80,2 °С при 6,25 кПа. Смешивается в любых соотношениях с водой.
При воздействии 65% -ного р-ра Н2О2 на бумагу, опилки и другие горючие вещества происходит их воспламенение.
Концентрированный раствор может взрываться. Для раствора пероксида водорода низкой концентрации возможно саморазложение при воздействии тепла.
В присутствии органической пыли или веществ, действующих каталитически (металлы, соли металлов).
Хранить растворы пероксида водорода в темном прохладном месте. В присутствии Н2О2 средства тушения обильные струи воды.
Можно ли получить перекись водорода из водорода и кислорода
Можно ли получить Н2О2 непосредственным взаимодействием водорода и кислорода? В реакции взаимодействия водорода с кислородом образуется пероксид водорода в качестве промежуточного продукта при горении водорода:
Так как температура горения водорода очень высока перекись водорода сразу же разлагается на воду и кислород:
Для определения образования перекиси водорода можно воспользоваться кусочком льда. Для этого нужно направить водородное пламя на кусок льда.
В образующейся воде можно обнаружить следы пероксида водорода. Также пероксид водорода можно получить при действии атомарного водорода на кислород.
Непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Статья на тему Разложение пероксида водорода
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Допишите уравнение реакции разложения пероксида водорода и расставьте необходимые коэффициенты: H2O2 = … + …
Пероксид водорода разлагается на воду и кислород:
H2O2 → H2O + O2↑
В правой части схемы у нас 3 атома кислорода: один в молекуле воды и два в молекуле кислорода. В левой части – два атома кислорода в молекуле перекиси. Казалось бы, наименьшее кратное – шесть. Но! В правой части 3 атома кислорода не в одной молекуле, а в двух разных (1+2). Поэтому у молекулы перекиси мы поставим коэффициент два:
2H2O2 → H2O + O2↑
Теперь очевидно, что уравнять схему можно добавив коэффициент два перед молекулой воды:
Видео:Галилео. Эксперимент. Разложение перекиси водородаСкачать

Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н + , а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н + + 2 
На аноде: 2HSО4 — — 2 
или 2H2SO4 = H2S2O8 + 2H + + 2
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 
На аноде: 2HSО4 — — 2 
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
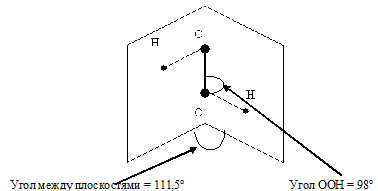
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
4О — = О2 0 + 2О 2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10 -3 м 3 . Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
📹 Видео
Получение кислорода из пероксида водородаСкачать

Разложение пероксида водорода под действием каталазыСкачать

Водород и кислород. 1 часть. 8 класс.Скачать

Гомогенное каталитическое разложение пероксида водородаСкачать

Реакции разложенияСкачать

Разложение ПЕРЕКИСИ ВОДОРОДАСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение перекиси водорода в присутствии катализатораСкачать

Опыты по химии. Получение кислорода из перманганата калияСкачать

Каталитическое разложение пероксида водорода + измерение признака реакцииСкачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Решение упражнений по теме Химические свойства кислородаСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Реакции разложенияСкачать

опыт Определение наличия ферментов, расщепляющих перекись водородаСкачать

Реакции разложения.ПримерыСкачать