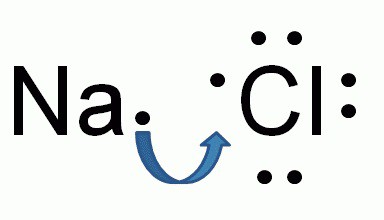Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
- Способ получения
- Качественная реакция
- Химические свойства
- Урок 9. Ионы в водном растворе
- Растворение соли в воде
- Электролиз растворов и расплавов солей
- Формула соли поваренной. Химическая формула: поваренная соль. Свойства поваренной соли
- Образование ионной связи между натрием и хлором
- Химическая формула. Поваренная соль и галит
- Физические свойства поваренной соли
- Получение хлорида натрия в лаборатории
- Производство поваренной соли
- Химические свойства хлорида натрия
- Сферы применения каменной соли
- 📸 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
5. Разбавленная хлороводородная кислота реагирует с гидроксидом натрия . Взаимодействие хлороводородной кислоты с гидроксидом натрия приводит к образованию хлорида натрия и воды:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Видео:Очистка поваренной соли (практическая работа)Скачать

Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид натрия образует нитрат натрия и осадок хлорид серебра:
NaCl + AgNO3 = NaNO3 + AgCl↓
Видео:Очистка загрязненной поваренной соли/8 классСкачать

Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.1. Твердый хлорид натрия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида натрия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, натрия, калия, газа хлора и воды:
2.2.2. Хлорид натрия взаимодействует с гидросульфатом натрия при температуре 450–800º C . При этом образуются сульфат натрия и хлороводородная кислота:
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Урок 9. Ионы в водном растворе
В уроке 9 «Ионы в водном растворе» из курса «Химия для чайников» рассмотрим растворение соли в воде, а также электролиз растворов и расплавов солей; познакомимся с законами Фарадея для электролиза и научимся находить продукты электролиза. Базой знаний для данного урока послужит материал из урока 8 «строение солей».
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Растворение соли в воде
Из прошлого урока нам известно, что соли трудно расплавить и еще сложнее довести ее до кипения, однако, полярные жидкости, такие как вода, способны растворять соли без особых усилий, поскольку неполные положительные и отрицательные заряды на атомах полярных молекул воды в какой-то мере заменяют собой положительные и отрицательные ионы в кристаллической решетке соли. Другими словами, молекулы воды помогают разрушить кристалл соли.
Из рисунка видно, что происходит с положительными и отрицательными ионами при растворении в воде кристалла поваренной соли NaCl. Каждый ион Na + окружается молекулами воды, которые обращены к нему отрицательно заряженными атомами кислорода. То же самое происходит с ионами Cl — , которые окружаются молекулами воды, обращенными к нему своими положительно заряженными атомами водорода. Ионы из кристалла соли оказываются гидратированными, а сам процесс присоединения молекул воды к ионам получил название — гидратация. Если в результате процесса гидратации устойчивость ионов, переходящих в раствор, становится больше их устойчивости в кристаллической решетке, то происходит растворение соли в воде. Хлорид натрия является отличным примером растворимой соли . И, наоборот, если энергия гидратации слишком мала, то кристалл является более устойчивой формой и не растворяется в воде. Примером таких нерастворимых солей является сульфат бария (BaSO4) и хлорид серебра (AgCl). Когда кристалл растворяется, он не просто распадается на ионы, а разъединяется на ионы молекулами жидкости, в которой происходит растворение. Неполярные жидкости (например, бензин С8H18) НЕ способны разъединять ионы в кристаллической решетке солей.
Видео:Фильтрование. Выпаривание. Очистка поваренной соли.Скачать

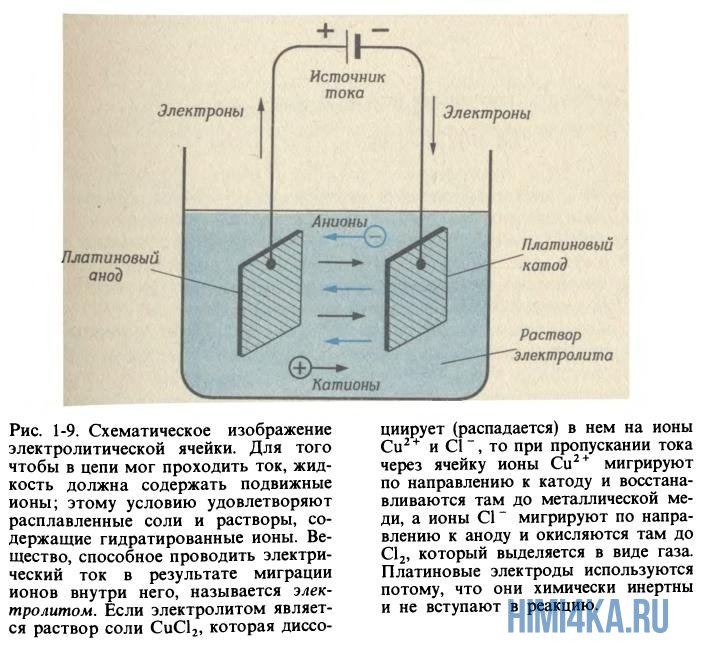
Электролиз растворов и расплавов солей
Металлы хорошо проводят ток — это знает каждый школьник. Электропроводность в металлах вызвана перемещением электронов в них, но ионы металла остаются неподвижными. Хотя кристаллы солей не проводят ток, зато растворы и расплавы солей это умеют и практикуют, так как анионы (отрицательные ионы) и катионы (положительные ионы) могут направленно перемещаться в противоположные направления, если приложить напряжение. Подвижность ионов соли оказывается еще большей, если она подверглась процессу гидратации.
Давным-давно английский ученый Майкл Фарадей расплавил соль (нагрев ее выше 801ºС), затем погрузил в расплав два электрода (катод и анод), а после взял и пропустил электрический ток через расплавленную соль. После этих манипуляций он обратил внимание что на электродах начали протекать химические реакции: ионы натрия начали мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия
Хлорид-ионы мигрируют в другом направлении-в сторону анода, отдают ему свои избыточные электроны и окисляются до газообразного хлора
Все это можно изобразить с помощью полной реакции, которая представляет собой разделение NaCl на составляющие его элементы:
Весь процесс получил название электролиз, что означает «разрыв на части при помощи электричества». Для электролиза не обязательно расплавлять соль, можно также использовать обычный водный раствор соли, ведь подвижность ионов оказывается еще большей, если соль подверглась процессу гидратации. Но тогда полная реакция будет выглядеть иначе, и на катоде будет выделяться не металлический натрий, а газообразный водород:
Надеюсь, что вам стало интересно, почему продуктом электролиза водного раствора является не Na (как это было в расплавленной соли), а ½H2. Объясняется просто: часть молекул H2O диссоциируют на ионы H + и OH — . Поскольку ион H + обладает большим сродством к электрону (то есть сильнее его притягивает), нежели ион Na + , то ионы H + первыми достигают катода, где незамедлительно восстанавливают недостающий электрон и превращаются из иона в полноценный газ H2, а ионы Na + так и остаются в растворе.
Вот вам плюшка с продуктами электролиза водного раствора солей, может пригодится — может нет, но лучше законспектируйте:
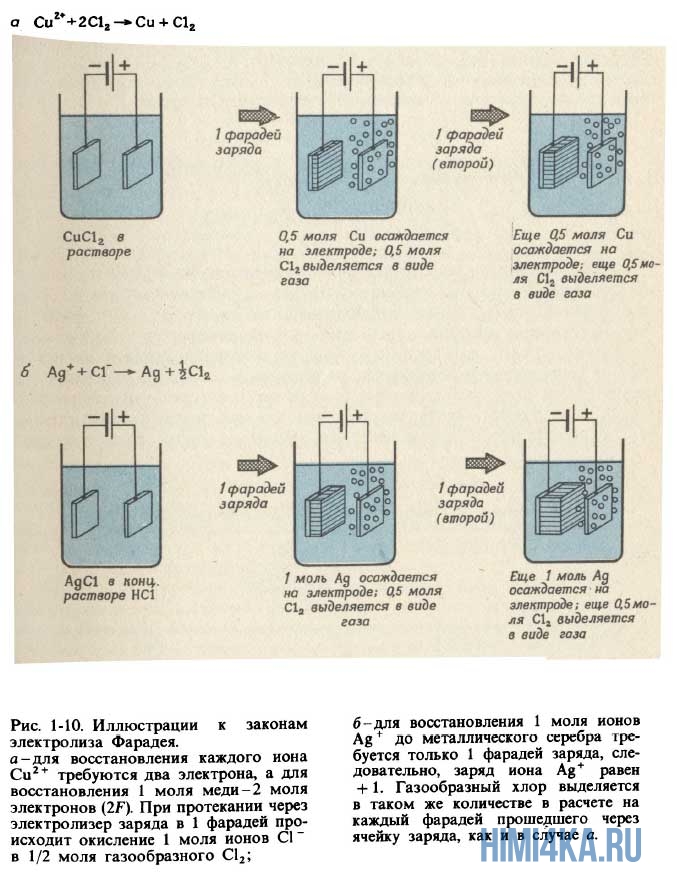
А Фарадей тем временем не сидел без дела, а наблюдал, проводил опыты, использовал другие электролиты, увеличивал-уменьшал заряд и опять наблюдал. В конце концов он заметил взаимосвязь между количеством подаваемого электричества и количеством получаемых веществ. Установленные им закономерности называются законы Фарадея для электролиза. Сформулируем их:
- Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса элемента, выделяемого на электроде, пропорциональна количеству заряда, пропущенному через электролитическую ячейку.
- Для выделения на электроде 1 моля вещества, которое в процессе электрохимической реакции приобретает или теряет 1 электрон, необходимо пропустить через ячейку 96485 кулонов (Кл) электричества. Если в реакции принимает участие N электронов, для выделения моля продукта необходимо N ·96485 Кл электричества.
Количество электричества, равное 96485 Кл, получило название 1 фарадей и обозначается символом F. Законы Фарадея становятся очевидными, если принять во внимание, что 1 F — это просто заряд 1 моля электронов, т.е. 6,022 1023 электронов. Множитель 6,022-1023, позволяющий переходить от индивидуальных молекул к молям вещества, одновременно позволяет перейти и от 1 электронного заряда к 1 F электрического заряда. Разумеется, в свое время Фарадей ничего не знал ни о числе Авогадро, ни о заряде электрона. Однако из проведенных экспериментов он смог сделать вывод, что заряды на ионах кратны некоторой элементарной единице заряда, так что 96485 Кл электричества соответствуют 1 молю таких единиц. Термин электрон впервые появился в 1881 г.; его ввел английский физик Дж.Стоней для обозначения элементарной единицы ионного заряда. Применять термин «электрон» к реальной отрицательно заряженной частице начали спустя еще 10 лет.
1 пример. Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль NaCl. Сколько граммов натрия и хлора выделится при пропускании 1 F электричества через электролитическую ячейку?
Решение: Уравнение реакции, протекающей на катоде: Na + + е — → Na, а уравнение 1 анодной реакции: Сl — → Cl2 + е — . Когда через расплавленную соль NaCl проходит 1 моль электронов (1 F), каждый электрон восстанавливает 1 ион натрия, в результате чего образуется 1 моль атомов натрия. Следовательно, на катоде выделяется 22,990 г Na. На аноде происходит удаление 1 моля электронов от 1 моля хлорид-ионов, после чего остается 1 моль атомов хлора, которые попарно соединяются, образуя 1/2 моля молекул Сl2. Следовательно, масса газообразного хлора, выделяющегося на аноде, должна быть равна 35,453 г (что равно атомной массе Сl, или половине молекулярной массы Сl).
Пример 2. Сколько граммов металлического магния и газообразного хлора выделяется при пропускании 1 F электричества через электролитическую ячейку с расплавленным хлоридом магния, MgCl2?
Решение: На катоде происходит реакция Mg 2+ + 2е — → Mg, а на аноде — реакция 2Сl — → Сl2 + 2е — . Поскольку для восстановления каждого иона Mg 2+ необходимо 2 электрона, 1 моля электронов хватит только для восстановления половины моля ионов магния, таким образом на катоде должно выделиться 12,153 г магния. (Атомная масса магния равна 24,305 г/моль.) Как и в примере 1, на аноде окислится 1 моль ионов Сl — и выделится половина моля, т.е. 35,453 г, газообразного Сl2.
Пример 3. Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы Аl 3 + . Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг металла.
Решение: 1 кг алюминия содержит 1000 г / 26,98 г·моль -1 = 37,06 моля атомов. Поскольку на выделение каждого атома алюминия необходимо 3 электрона, на 37,06 моля атомов потребуется 3·37,06 = 111,2 моля электронов. Это количество электричества эквивалентно 111,2F, или 10 730 000 Кл.
Надеюсь урок 9 «Ионы в водном растворе» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к уроку 10 «Ионы в газе».
Видео:8 класс Растворение веществ в водеСкачать

Формула соли поваренной. Химическая формула: поваренная соль. Свойства поваренной соли
Поваренная соль — это хлорид натрия, применяемый в качестве добавки к пище, консерванта продуктов питания. Используется также в химической промышленности, медицине. Служит важнейшим сырьем для получения едкого натра, соляной кислоты, соды и других веществ. Формула соли поваренной — NaCl.
Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

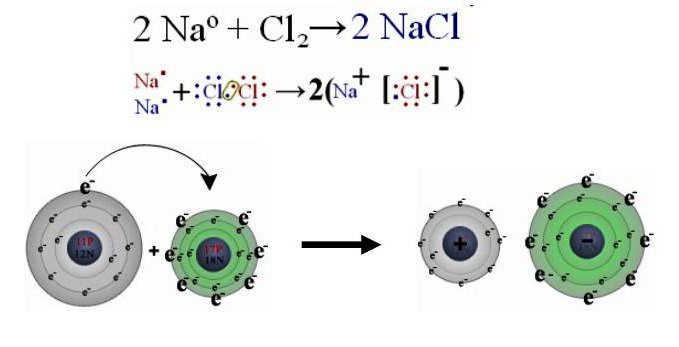
Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условная формула NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но вещество образовано не двухатомными молекулами, а состоит из кристаллов. При взаимодействии щелочного металла с сильным неметаллом каждый атом натрия отдает валентный электрон более электроотрицательному хлору. Возникают катионы натрия Na + и анионы кислотного остатка соляной кислоты Cl — . Разноименно заряженные частицы притягиваются, образуя вещество с ионной кристаллической решеткой. Маленькие катионы натрия расположены между крупными анионами хлора. Число положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом является нейтральным.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Химическая формула. Поваренная соль и галит
Соли — это сложные вещества ионного строения, названия которых начинаются с наименования кислотного остатка. Формула соли поваренной — NaCl. Геологи минерал такого состава называют «галит», а осадочную породу — «каменная соль». Устаревшей химический термин, который часто употребляется на производстве, — «хлористый натрий». Это вещество известно людям с глубокой древности, когда-то его считали «белым золотом». Современные ученики школ и студенты при чтении уравнений реакций с участием хлорида натрия называют химические знаки («натрий хлор»).
Проведем несложные расчеты по формуле вещества:
1) Mr (NaCl) = Ar (Na) + Ar (Cl) = 22,99 + 35,45 = 58,44.
Относительная молекулярная масса составляет 58,44 (в а.е.м.).
2) Численно равна молекулярному весу молярная масса, но эта величина имеет единицы измерения г/моль: М (NaCl) = 58,44 г/моль.
3) Образец соли массой 100 г содержит 60,663 г атомов хлора и 39,337 г натрия.
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Физические свойства поваренной соли
Хрупкие кристаллы галита — бесцветные или белые. В природе также встречаются месторождения каменной соли, окрашенной в серый, желтый либо голубой цвет. Иногда минеральное вещество обладает красным оттенком, что обусловлено видами и количеством примесей. Твердость галита по шкале Мооса составляет всего 2-2,5, стекло оставляет на его поверхности черту.
Другие физические параметры хлорида натрия:
- запах — отсутствует;
- вкус — соленый;
- плотность — 2,165 г/ см3 (20 °C);
- температура плавления — 801 °C;
- точка кипения — 1413 °C;
- растворимость в воде — 359 г/л (25 °C);
Видео:СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Получение хлорида натрия в лаборатории
При взаимодействии металлического натрия с газообразным хлором в пробирке образуется вещество белого цвета — хлорид натрия NaCl (формула поваренной соли).
Химия дает представление о различных способах получения одного и того же соединения. Вот некоторые примеры:
Окислительно-восстановительная реакция между металлом и кислотой:
2Na + 2HCl = 2NaCl + Н2.
Действие кислоты на оксид металла: Na2O + 2HCl (водн.) = 2NaCl + H2O
Вытеснение слабой кислоты из раствора ее соли более сильной:
Для применения в промышленных масштабах все эти методы слишком дорогие и сложные.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Производство поваренной соли
Еще на заре цивилизации люди знали, что после засолки мясо и рыба сохраняются дольше. Прозрачные, правильной формы кристаллы галита использовались в некоторых древних странах вместо денег и были на вес золота. Поиск и разработка месторождений галита позволили удовлетворить растущие потребности населения и промышленности. Важнейшие природные источники поваренной соли:
- залежи минерала галита в разных странах;
- вода морей, океанов и соленых озер;
- прослойки и корки каменной соли на берегах соленых водоемов;
- кристаллы галита на стенках вулканических кратеров;
- солончаки.
В промышленности используются четыре основных способа получения поваренной соли:
- выщелачивание галита из подземного слоя, испарение полученного рассола;
- добыча в соляных шахтах;
- выпаривание морской воды или рассола соленых озер (77% от массы сухого остатка приходится на хлорид натрия);
- использование побочного продукта опреснения соленых вод.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства хлорида натрия
Видео:Лабораторный опыт. "Очистка загрязнённой поваренной соли."Скачать

Сферы применения каменной соли
Хлорид натрия снижает температуру плавления льда, поэтому зимой на дорогах и тротуарах используется смесь соли с песком. Она впитывает в себя большое количество примесей, при таянии загрязняет реки и ручьи. Дорожная соль также ускоряет процесс коррозии автомобильных кузовов, повреждает деревья, посаженные рядом с дорогами. В химической промышленности хлорид натрия используется как сырье для получения большой группы химических веществ:
- соляной кислоты;
- металлического натрия;
- газообразного хлора;
- каустической соды и других соединений.
Кроме того, поваренная соль применяется в производстве мыла, красителей. Как пищевой антисептик используется при консервировании, засолке грибов, рыбы и овощей. Для борьбы с нарушениями работы щитовидной железы у населения формула соли поваренной обогащается за счет добавления безопасных соединений йода, например, KIO3, KI, NaI. Такие добавки поддерживают выработку гормона щитовидной железы, предотвращают заболевание эндемическим зобом.
📸 Видео
Растворение. Растворимость веществ в воде | Химия 8 класс #39 | ИнфоурокСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Практическая работа по химии "Очистка загрязненной поваренной соли различными методами"Скачать

Очистка поваренной соли (практическая работа)Скачать

Растворение соли в воде при комнатной температуреСкачать

Растворы. 8 класс.Скачать