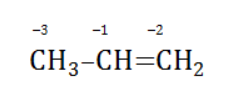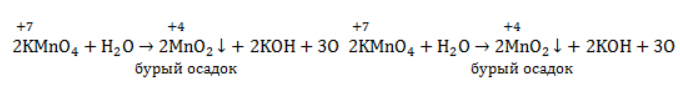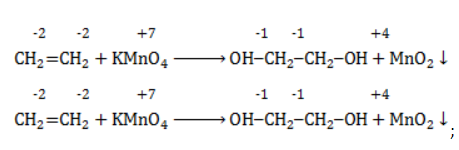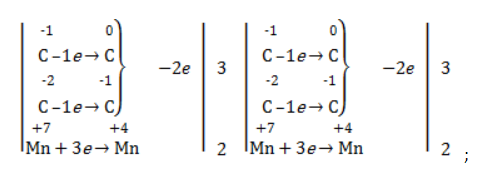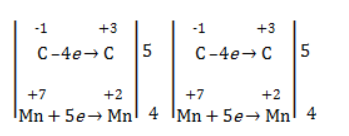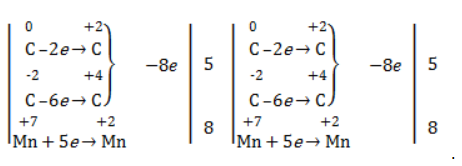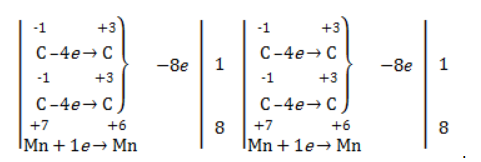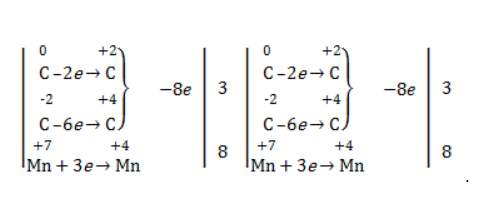- Жесткое окисление алкенов в кислой среде
- Пропен + KMnO4 +H2SO4
- 2-метилпропен + KMnO4 + H2SO4
- Пропен + K2Cr2O7 + H2SO4
- 2-метилпропен + K2Cr2O7 + H2SO4
- Химические свойства алкинов
- Химические свойства алкинов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкинов
- 1.3. Гидрогалогенирование алкинов
- 1.4. Гидратация алкинов
- 1.5. Димеризация, тримеризация и полимеризация
- 2. Окисление алкинов
- 2.1. Горение алкинов
- 2.2. Окисление алкинов сильными окислителями
- 3. Кислотные свойства алкинов
- Окисление алкенов перманганатом калия
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- 🎦 Видео
Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Жесткое окисление алкенов в кислой среде
Данный процесс чаще всего осуществляют, действуя на алкены подкисленным раствором перманганата калия, либо дихромата калия. В качестве средообразователя всегда используют серную кислоту. При таком окислении происходит полный разрыв углеродного скелета по двойной связи, и в зависимости от особенностей строения продуктами окисления могут быть различные вещества.
Давайте сначала разберемся с тем, какие углеродсодержащие продукты образуются при жестком окислении алкенов с различным строением. Представим, что у нас стоит задача определить продукты окисления для следующих двух веществ:
Обратите внимание, что углеродные атомы при двойной связи обозначены разными цветами.
Атом углерода, выделенный красным цветом, является первичным, то есть связан только с одним другим атомом углерода.
Атом углерода, выделенный желтым цветом, является вторичным, то есть связан с двумя другими атомами углерода.
Атом углерода, выделенный зеленым цветом, является третичным, то есть связан с тремя другими атомами углерода.
Жесткое окисление подразумевает разрыв углеродного скелета по месту двойной связи:
Следует запомнить, что первичные атомы углерода (красные) при таком окислении переходят в углекислый газ.
Вторичные атомы углерода (желтые) переходят в состав карбоксильной группы (COOH), то есть образуется карбоновая кислота.
Третичные атомы углерода(зеленые) переходят в состав карбонильной группы, то есть образуется кетон.
Теперь осталось разобраться с остальными продуктами реакции. Если в качестве окислителя используется сернокислый раствор перманганата калия, то продуктами будут также MnSO4, K2SO4 и H2O. Если же в качестве окислителя взяли сернокислый раствор дихромата калия, продуктами будут Cr2(SO4)3, K2SO4 и H2O.
Давайте разберем все эти случаи. Начнем с реакции пропена с сернокислым раствором перманганата калия.
Пропен + KMnO4 +H2SO4
Исходя из вышесказанного, запишем схему этой реакции:
Осталось расставить коэффициенты. Определим, какие атомы изменили степени окисления. В случае марганца ничего сложного нет: степень окисления его в перманганате была +7, стала равна +2. Также степени окисления меняют те атомы углерода, у которых изменилось окружение. В схеме эти атомы обозначены желтым и красным цветами. Определим степени окисления этих атомов методом блоков. Изолируем друг от друга фрагменты молекулы по углерод-углеродным связям следующим образом:
Далее, условно примем, что заряд каждого выделенного блока равен нулю (как у нейтральной молекулы). Степень окисления водорода в органических веществах всегда равна +1. Обозначим степени окисления «желтого» атома С как х, «красного» — как y:
Далее, учитывая, что заряд каждого блока мы приняли равным нулю, мы можем составить и решить два уравнения:
Аналогично рассчитаем степень окисления «желтого» атома углерода в уксусной кислоте и «красного» в молекуле углекислого газа, учитывая, что степень окисления кислорода в органических веществах всегда равна -2 (кроме органических пероксидов, изучение которых в не входит в программу ЕГЭ):
Далее, аналогично, составим и решим два уравнения, учитывая, что заряд выделенного блока мы приняли равным нулю, а заряд молекулы углекислого газа, как и у любой другой молекулы, также нейтрален.
Таким образом, «желтый» атом углерода имел степень окисления до реакции, равную -1, а после +3.
«Красный» атом углерода изменил свою степень окисления с -2, на +4.
Учитывая, что марганец изменил свою степень окисления с +7 на +2, еще раз запишем схему реакции и составим электронный баланс. «Желтый» и «красный» атомы углерода, очевидно, всегда будут в соотношении 1 к 1, независимо от коэффициента перед органическим веществом, потому запишем их в одной строчке «полуреакции» окисления.
Перенесем коэффициенты из баланса:
Поскольку в левой части схемы мы видим два атома калия, в правой части схемы перед сульфатом калия коэффициент 1, ставить который не нужно. В правой части уравнения мы видим 3 сульфатных остатка, поэтому ставим перед серной кислотой коэффициент 3:
Осталось поставить коэффициент перед водой в правой части. Это можно сделать по кислороду или водороду на выбор. Поскольку мы уравняли число сульфатных остатков в левой и правой частях, то кислород в них можно не учитывать. Считаем только кислород в остальных соединениях. Слева мы видим 8 атомов кислорода (не считая кислород в серной кислоте). В правой части не считая воду — 4 атома кислорода. Поэтому перед водой коэффициент будет равен 4:
Сравнивая количества всех элементов слева и справа, видим, что все коэффициенты расставлены верно.
2-метилпропен + KMnO4 + H2SO4
Аналогично предыдущему примеру рассчитаем степени окисления углеродных атомов, которые изменили свою степень окисления:
Учитывая, что заряд каждого выделенного блока мы приняли равным нулю, составим и решим уравнения:
Аналогично поступим с продуктами окисления:
составим и решим уравнения:
Таким образом, «зеленый» атом углерода до реакции имел степень окисления, равную 0, после +2, «красный» изменил свою степень окисления с -2 на +4.
Далее запишем схему окисления и составим электронный баланс:
Перенесем коэффициенты из электронного баланса в схему:
Далее мы видим, что в левой части схемы 8 атомов калия, потому перед сульфатом калия поставим коэффициент 4.
Теперь можно заметить, что в правой части уравнения 12 сульфатных групп (8 в сульфате марганца, 4 в сульфате калия). Поэтому перед серной кислотой в левой части нужно поставить коэффициент 12:
Осталось поставить коэффициент перед водой. Сделаем это по кислороду. Количество сульфатных групп мы уравняли, потому кислород в них можно не учитывать. Слева мы видим 32 атома кислорода (8*4). В правой части уравнения, не считая воды и сульфатных групп, 15 атомов кислорода (5 в молекуле кетона и 10 в 5 молекулах углекислого газа). Таким образом, перед водой необходимо поставить коэффициент 17.
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
Пропен + K2Cr2O7 + H2SO4
Состав продуктов будет точно таким же, как и в случае окисления перманганатом, за исключением того, что вместо сульфата марганца (II) образуется сульфат хрома (III). Запишем схему реакции и составим электронный баланс.
Перенесем коэффициенты из баланса в схему:
Далее уравняем калий, поставив коэффициент 5 перед сульфатом калия:
В правой части мы видим 20 сульфатных групп. Следовательно, перед формулой серной кислоты нужно поставить коэффициент 20:
Осталось поставить последний коэффициент перед формулой воды. Сделаем это, как и в двух предыдущих случаях, по кислороду, не считая кислород в сульфатных группах, поскольку их количества уравнены. В левой части мы видим 35 атомов кислорода. В правой части, не считая воды, 12 атомов кислорода (6 в трех молекулах CH3COOH и 6 в трех молекулах CO2). Таким образом, перед формулой воды нужно поставить коэффициент 23:
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
2-метилпропен + K2Cr2O7 + H2SO4
Запишем схему реакции и электронный баланс:
Перенесем коэффициенты из баланса в схему:
Перед сульфатом калия поставим коэффициент 4, чтобы уравнять количества атомов калия в левой и правой частях схемы:
Перед серной кислотой поставим коэффициент 16, чтобы уравнять количество сульфатных групп:
Последний коэффициент перед водой поставим по кислороду, игнорируя сульфатные группы, поскольку их количество уравнено. Слева мы видим 28 атомов кислорода. Справа, не считая воды, 9 атомов кислорода. Таким образом, перед водой необходимо поставить коэффициент 19.
Далее, подсчитав водород в обеих частях уравнения, убеждаемся, что коэффициенты расставлены верно.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Химические свойства алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Видео:Окисление органических соединений перманганатом калияСкачать

Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
Видео:ЕГЭ ХИМИЯ/Окисление пропена в жестких условиях/органикаСкачать

1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С – С | 348 | 0,154 |
| С ≡ С | 814 | 0,120 |
| С – Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать

2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
| Например, уравнение сгорания пропина: |
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C ≡ | R-COOH | -COOMe |
| CH ≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C ≡ , поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C ≡ C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Видео:ОВР с перманганатом калия.Скачать

Окисление алкенов перманганатом калия
В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
Видео:10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
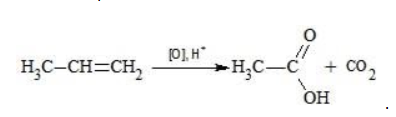
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.Скачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

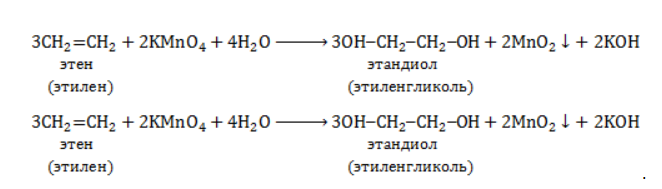
Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 
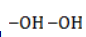
- кислород из перманганат-иона;
- вода.
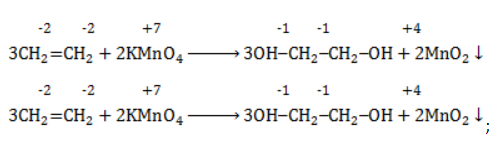
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
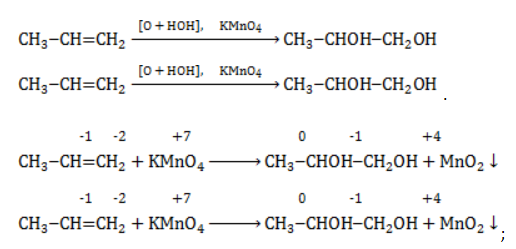
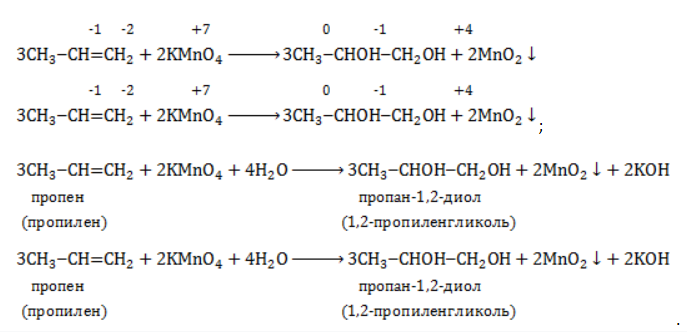
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 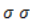
Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
Окисление перманганатом калия в кислой среде
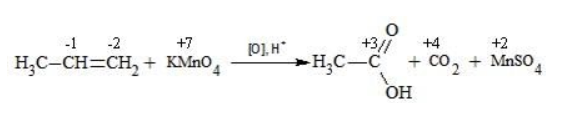
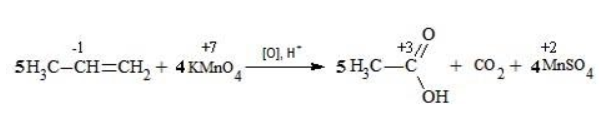
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
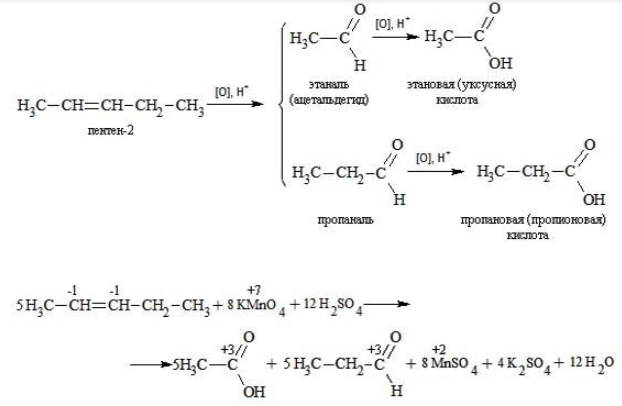
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
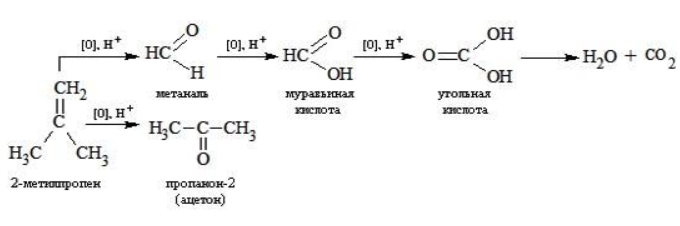
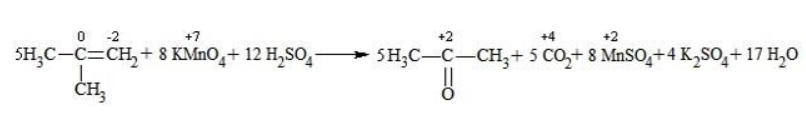
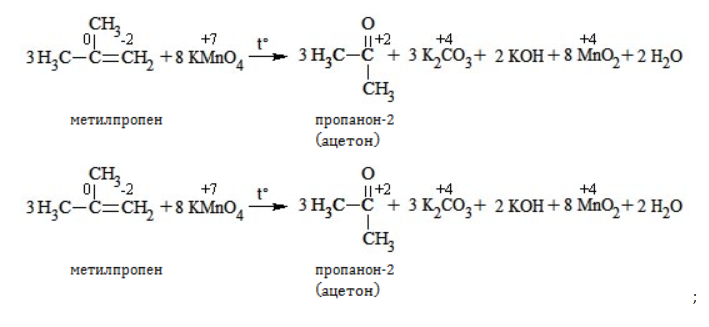
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:окисление алкенов в кислой средеСкачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
🎦 Видео
Жесткое окисление алкенов. Взаимодействие алкенов с перманганатом калия в щелочной средеСкачать

Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Все органические ОВР: жесткое окисления за 2 часа | Химия ЕГЭ 2023 | УмскулСкачать

Химия с нуля — Химические свойства АлкеновСкачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

ОВР 5 занятие Окисление алкеновСкачать























 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей