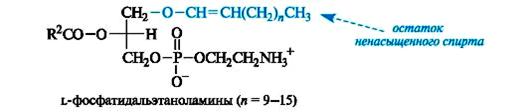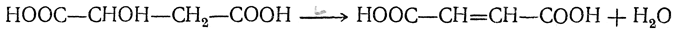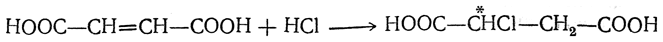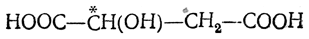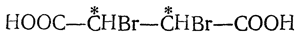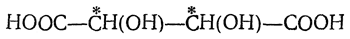Читайте также:
|
| Название кислоты | Формула | Название аниона или основы сложного эфира |
| Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая) | НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН | Оксалат Малонат Сукцинат Глутарат |
Систематические названия дикарбоновых кислот строятся по общим правилам заместительной номенклатуры. Однако для большинства из них предпочтительны тривиальные названия. Их латинские названия служат основой названия анионов и производных кислот, которые часто не совпадают с русскими тривиальными названиями.
Щавелевая кислота – простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Янтарная кислота в заметном количестве была обнаружена в янтаре, откуда получила название сама кислота и ее производные сукцинаты (от лат. succinium — янтарь).
Малеиновая и фумаровая кислоты – представители ненасыщенных дикарбоновых кислот с одной двойной связью. Фумаровая кислота участвует в обменных процессах, протекающих в организме.
Дикарбоновые кислоты образуют два ряда функциональных производных – по одной и по двум карбоксильным группам.
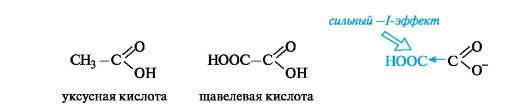
С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa 4,76), что связано с -I-эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.
Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру.
При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.
Малоновая кислота легко декарбоксилируется при нагревании выше 100 ºС.
В дикарбоновых кислотах, содержащих четыре или пять атомов углерода в цепи и способных вследствие этого находиться в клешневидной конформации, происходит сближение в пространстве функциональных групп. В результате внутримолекулярной атаки одной карбоксильной группой (нук- леофилом) электрофильного центра другой карбоксильной группы происходит образование (при нагревании) устойчивого пятиили соответственно шестичленного циклического ангидрида, как показано на примерах янтарной и глутаровой кислот. Другими словами, ангидриды дикарбоновых кислот являются продуктами внутримолекулярной циклизации.
Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных – кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.
Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД. Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме – фумарат).
2. Фосфолипиды. Фосфатидовые (фосфатидные) кислоты. Фосфатидилколамины и фосфатидилсерины (кефалины), фосфатидилхолины (лецитины) – структурные компоненты клеточных мембран.
Согласно общей классификации липидов сложные липиды обычно делят на три большие группы: фосфолипиды, сфинголипиды и гликолипиды.
В группу фосфолипидов входят вещества, отщепляющие при гидролизе фосфорную кислоту, например глицерофосфолипиды и некоторые сфинголипиды. В целом фосфолипидам свойственно достаточно высокое содержание ненасыщенных кислот.
Глицерофосфолипиды являются главными липидными компонентами клеточных мембран. По химическому строению глицерофосфолипиды представляют собой производные L-глицеро-З-фосфата.
L-Глицеро-З-фосфат содержит асимметрический атом углерода и, следовательно, может существовать в виде двух стереоизомеров.
Природные глицерофосфолипиды имеют одинаковую конфигурацию, являясь производными L-глицеро-З-фосфата, образующегося в процессе метаболизма из фосфата дигидроксиацетона.
Среди глицерофосфолипидов наиболее распространены фосфатиды – сложноэфирные производные L-фосфатидовых кислот.
Фосфатидовые кислоты – это производные L-глицеро-З-фосфата, этерифицированные жирными кислотами по спиртовым гидроксильным группам.
Как правило, в природных фосфатидах в положении 1 глицериновой цепи находится остаток насыщенной, в положении 2 – ненасыщенной кислоты, а один из гидроксилов фосфорной кислоты этерифицирован многоатомным спиртом или аминоспиртом (X – остаток этого спирта). В организме (рН
7,4) оставшийся свободным гидроксил фосфорной кислоты и другие ионогенные группировки в фосфатидах ионизированы.
Примерами фосфатидов могут служить соединения, в составе которых фосфатидовые кислотыэтерифицированы по фосфатному гидроксилу соответствующими спиртами:
• фосфатидилсерины, этерифицирующий агент – серин;
• фосфатидилэтаноламины, этерифицирующий агент – 2-аминоэтанол (в биохимической литературе часто, но не вполне правильно называемый этаноламином);
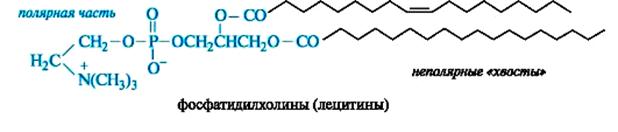
• фосфатидилхолины, этерифицирующий агент – холин.
Эти этерифицирующие агенты взаимосвязаны между собой, поскольку фрагменты этаноламина и холина могут образовываться в ходе метаболизма из фрагмента серина путем декарбоксилирования и последующего метилирования при помощи S-аденозилметионина (SAM).
Особенностью сложных липидов является их бифильность, обусловленная неполярными гидрофобными и высокополярными ионизированными гидрофильными группировками. В фосфатидилхолинах, например, углеводородные радикалы жирных кислот образуют два неполярных «хвоста», а карбоксильная, фосфатная и холиновая группы – полярную часть.
На границе раздела фаз такие соединения действуют, как превосходные эмульгаторы. В составе клеточных мембран липидные компоненты обеспечивают высокое электрическое сопротивление мембраны, ее непроницаемость для ионов и полярных молекул и проницаемость для неполярных веществ. В частности, большинство анестезирующих препаратов хорошо растворяются в липидах, что позволяет им проникать через мембраны нервных клеток.
Ряд фосфатидов вместо аминосодержащего этерифицирующего агента содержит остатки многоатомных спиртов – глицерина, миоинозита и др. Приведенные ниже в качестве примера фосфатидилглицерины и фосфатидилинозиты относятся к кислым глицерофосфолипидам, поскольку в их структурах отсутствуют фрагменты аминоспиртов, придающие фосфатидилэтаноламинам и родственным соединениям нейтральный характер.
Менее распространены по сравнению со сложноэфирными глицерофосфолипидами липиды с простой эфирной связью, в частности плазмалогены. Они содержат остаток ненасыщенного спирта, связанный простой эфирной связью с атомом С-1 глицеро-3-фосфата, как, например, плазмалогены с фрагментом этаноламина – L-фосфатидальэтаноламины. Плазмалогены составляют до 10% всех липидов ЦНС.
3. Приведите проекционные формулы стереоизомеров 2-амино-3-гидроксибутановой кислоты. Какая из формул соответствует L-треонину?
CH3 – CH – CH – COOH
 |  |




 |  |





В молекуле цАМФ:
Сложноэфирная связь: – Р – О – СН2 –
О-гликозидная связь: – Р – О – СН – (на схеме – длинная диагональная связь между фосфором и циклом).
N-гликозидная связь: – СН – N (на схеме – связь между рибофуранозным циклом и атомом азота). |
5. Осуществите превращения и назовите зашифрованные соединения.

Дата добавления: 2015-02-10 ; просмотров: 166 ; Нарушение авторских прав
Видео:Об этом НИКОГДА не напишут в инструкциях! Что творит ЯНТАРНАЯ КИСЛОТАСкачать

Цикл Кребса
Видео:Янтарная кислота - огромный риск, или ничтожная польза?Скачать

Что такое цикл Кребса

отравляется (ингибируется) солями малоновой кислоты. На рисунке 29 отравляющее действие малоната обозначено как «мало натный блок». В дальнейшем неожиданно выяснилось, что в мышце, отравленной малонатом, все-таки происходит окисление солей фумаровой кислоты так, что получается сукцинат (соль янтарной кислоты). Это означает, что в клетках существует какой-то иной, круговой путь, ведущий от фумаровой кислоты к янтарной, но не связанный с преодолением «малонатного блока».
Рис. Цикл Кребса или цикл ди- и трикарбоновых кислот.
Обширные и тонкие исследования привели Г. Кребса к выводу, что определенные ди- и трикарбоновые кислоты совместно с системой ферментов образуют каталитический цикл. С помощью этого цикла природа извлекает энергию из процесса окисления веществ, получающихся из углеводов, жирных кислот и белков, превращая их в воду, оксид углерода (IV) и др. соединения и отщепляя водород. Атомы водорода в конечном счете соединяются с кислородом, а. энергия, соответствующая реакции окисления, запасается в молекулах аденозинтрифосфорной кислоты. Таким образом, цикл Кребса представляет собой составную часть того механизма, который обеспечивает клетке необходимый приток энергии. Круговую последовательность реакций Г. Кребс назвал циклом лимонной кислоты; в настоящее время ее называют циклом ди- и трикарбоновых кислот или циклом Кребса.
Функции цикла разнообразны и важны для поддержании почти всех процессов жизнедеятельности. Мы рассмотрим химическую сторону цикла.Кребса, обратив внимание па превращения, в которых исходным веществом является углевод — глюкоза.
В результате действия целого ряда ферментов глюкоза превращается в пировиноградную кислоту СН3СОСООН, которая окисляется в клетках до ацетилкофермента А так, что получается активное соединение СН3—СО—S-KoA.
Кофермент А подготавливает остаток уксусной кислоты— ацетил СН3СО — к дальнейшей переработке в цикле Кребса.
Так как кофермент А в конечном итоге регенерируется, то формально можно сказать, что результатом деятельности цикла является дегидрирование уксусной кислоты:
Проследим, что же происходит с ацетилкоферментом А.
Доказано, что при определенных условиях он может превращаться в жирные кислоты; реакция эта обратима, и, следовательно, жирные кислоты (а также и жиры после омыления) способны входить в цикл (см. левую верхнюю часть рис.). Если же ацетилкофермент А не израсходован на образование жирных кислот, то он реагирует со щавелевоуксусной кислотой и кофермент А при этом освобождается. Первая реакция цикл Кребса может схематически быть записана так:
Реакция катализируется ферментом цитрат-синтазой (название связано с функцией фермента — в результате реакции синтезируется лимонная кислота).
2. Лимонная кислота под влиянием фермента аконитазы превращается в изолимонную:
Фермент аконитаза, нуждающийся для проявления активности в ионах железа (II) и цистеине, обладает замечательными свойствами. В приведенной выше реакции он ускоряет превращение цис-формы аконитовой кислоты в лимонную и изолимонную и соответственно обратно (в равновесной смеси 91% приходится на лимонную, 6% на изолимонную и 3% на аконитовую кислоты при 25° С и рН 7,4). Характерно в этом эффекте то, что один и тот же катализатор катализирует две реакции: с одной стороны, отнимает в процессе дегидратации лимонной кислоты группу ОН у третичного атома углерода, а с другой — отщепляет группу ОН от вторичного атома углерода (дегидратация изолимонной кислоты).
Это возможно лишь при условии, что молекула субстрата соединяется с поверхностью фермента по крайней мере в трех его различных точках.
Так как в реакции принимает участие ион Fe 2+ , то было высказано предположение, что превращение лимонной кислоты в изолимонную происходит внутри комплекса, образуемого ионом железа Fe 2+ с лимонной кислотой. Комплекс и связан
с белком фермента в трех точках: фермент отщепляет ион водорода от атома углерода (2), остаток приобретает отрицательный заряд и от него по этой причине легче отделяется ион ОН — , соединенный с углеродом (3).
Гидроксильный ион переходит к иону Fe 2+ . Затем следует поворот комплекса, изменение конформации молекулы и группа ОН — попадает к атому углерода (2), а ион водорода возвращается к атому углерода, но уже не к (2), а (3). Образуется изоцитрат; аконитат с этой точки зрения представляет собой промежуточное вещество, связанное с белком фермента
Превращение лимонной кислоты в изолимонную в комплексе с железом и ферментом: А — лимонная кислота; Б— изолимонная кислота; Е — белок фермента.
3. Далее следует реакция дегидрирования:
Эта реакция заключается в отщеплении водорода от изолимонной кислоты, причем водород переходит к активной группе — коферменту изоцитратдегидрогеназы. Активная группа представляет собой уже известный нам НАД + (никотинамид адениндинуклеотид) или НАДФ + (никотинамидадениндинуклеотидфосфат). Фермент активируется ионами Мn 2+ .
4. Из щавелевоянтарной кислоты образуется α-кетоглутаровая кислота:
Реакция превращения щавелевоянтарной кислоты в кетоглутаровую является процессом декарбоксилирования, т. е. удаления СО2 за счет расщепления группы СООН. Процесс катализируется тем же ферментом, что и предыдущая реакция с участием НАДФ + и ионов Мn 2+ .
5. Кетоглутаровая кислота, теряя водород и оксид углерода (IV), превращается в сукцинил-КоА:
В этой сложной реакции участвует кофермент НАД + и KoA-SH; реакция протекает через промежуточные стадии, для которых необходимы ФАД, липоевая кислота и тиаминпирофосфат.
6. Производное кофермента А вступает в реакцию с гуанозиндифосфатом и фосфатом (обозначены ГДФ + Ф), в результате чего вновь получается KoA-SH и синтезируется гуанозинтрифосфат (ГТФ):
Реакция ускоряется ферментом сукцинилтиокиназой. Получившийся в результате ГТФ реагирует далее с АДФ, отдавая ей фосфатный остаток:
ГТФ + АДФ—ГДФ + АТФ.
Поэтому в конечном счете энергия, доставляемая этим процессом, накапливается в молекулах АТФ.
7. Янтарная кислота окисляется в фумаровую, отщепляя водород под действием фермента, о котором мы упоминали в начале описания цикла Кребса, именно сукцинатдегидрогеназы:
8. Фумаровая кислота гидратируется, т. е. присоединяет воду и превращается в яблочную кислоту (или ее соли — малаты). Реакция катализируется ферментом фумаразой и легко обратима.
Фумараза действует так, что присоединение ионов Н + и ОН — происходит по разные стороны двойной связи фумаровой кислоты:
9. Завершающая стадия цикла Кребса заключается в окислении малата в соль щавелевоуксусной кислоты (в оксалоацетат).
Катализатором является фермент малатдегидрогеназа, имеющая в качестве кофермента НАД + . Процесс окисления, т. е. передачи водорода от малата НАД + , сопровождается поглощением энергии. Сдвиг равновесия вправо объясняется быстрым удалением продуктов реакции:
На этом цикл заканчивается. Два атома углерода, вошедшие в него в форме СН3—СО, в ходе реакций выделяются в виде СО2. Изотопные методы позволили обнаружить, что оксид углерода (IV) СО2 содержит не те атомы углерода, которые содержались в остатке СН3СО, а другие, так что в цикле совершается постоянный обмен атомов углерода между кислотами и входящими в цикл веществами.
Восемь атомов водорода, образующиеся в процессах дегидрирования, присоединяются к коферментам (шесть —к НАД + и два к ФАД). В дальнейшем атомы водорода отдадут свои электроны в цепь переносчиков (цитохромов), а сами уже в форме ионов Н + присоединятся к попам кислорода.
Таковы сложные пути процесса окисления уксусной кислоты, который мы в начале этого раздела выразили балансовым уравнением:
В конечном счете водород с кислородом, которым дышат организмы, дает воду 8Н + 2О2→4Н2О. Это уравнение тоже балансовое и фактически соединение ионов водорода и кислорода является сложным процессом, катализируемым специальным ферментом.
Рассмотрим итоги цикла. Два электрона (два атома водорода) были получены уже в процессе предварительной подготовки пировиноградной кислоты — ее превращении в ацетил-КоА, после этого в самом цикле по два электрона получались при окислении изолимонной кислоты — «на уровне» изоцитрата, на уровне кетоглутаровой кислоты (кетоглутарата) и на уровнях янтарной и яблочной кислот (сукцинат и малат) Всего получается 10 электронов.
К этому надо добавить, что пировиноградная кислота получается из глюкозы, проходит стадию молочной кислоты, т. е. окисление идет в такой последовательности:
глюкоза — молочная кислота — пировиноградная кислота
и на стадии превращения молочной кислоты в пировиноградную также отщепляются два атома водорода:
СН3СН (ОН) СООН — СН3СОСООН + 2Н.
Всего таким образом в систему НАДФ—ФП — цитохромы от одной молекулы молочной кислоты попадает 12 электронов.
В цикле Кребса есть некоторая особенность: электроны, отщепляемые на уровне сукцината, попадают не к НАД, а, несколько обгоняя остальные, прямо к флавопротеидам. Но на
переходе от НАД к ФП совершается окислительное фосфорилирование — именно там на каждую прошедшую пару электронов образуется одна молекула АТФ. Следовательно, пара электронов, попавшая из цикла непосредственно к ФП, образует уже не три молекулы АТФ, как все остальные пары, а только две.
Но в самом цикле, именно на уровне кетоглутарата, часть выделившейся энергии идет на образование одной молекулы АТФ из неорганического фосфата и АДФ, поэтому в общем итоге из 6 пар электронов, прошедших по цепи, возникает 18 молекул АТФ, заряженных энергией из одной молекулы молочной кислоты. Но ведь молекула глюкозы содержит шесть атомов углерода, и из нее образуется две молекулы молочной кислоты и соответственно две молекулы пировиноградной кислоты. Поэтому молекула глюкозы должна дать при полном окислении 36 молекул АТФ, вобравших в себя энергию, заключенную в системе глюкоза и кислород или, точнее, разность энергий между этой системой и системой вода и оксид углерода (IV).
Запасы органических кислот цикла Кребса пополняются за счет так называемых «возмещающих» реакций. К ним относится взаимодействие пировиноградной кислоты с оксидом углерода (IV), катализируемое пируваткарбоксилазой и приводящее к накоплению щавелевоуксусной кислоты. Реакция поддерживается аденозинтрифосфорной кислотой и требует каталитического участия ионов магния:
На рисунке 29 этот процесс показан слева. Фермент, катализирующий поглощение оксида углерода (IV) пируватом, содержит в своем составе биотип — один из жизненно важных витаминов. Яблочная и щавелевоуксусная кислота получаются так же и путем декарбоксилирования фосфенолпировиноградной кислоты; на деталях этого процесса мы не будем останавливаться.
Рассмотрим теперь вопрос об отношении процессов усвоения белков к циклу Кребса.
Молекула белка прежде всего атакуется протеолитическими ферментами. Они разрывают пептидные связи и к освободившимся валентностям присоединяются водород и гидроксил, т. е. происходит гидролиз. В результате молекула белка распадается на аминокислоты:
После этого аминокислоты теряют азот, отщепляя его в виде аминогруппы. Потеря аминогруппы — только часть сложного процесса, имеющего общее название трансаминирования. Это значит, что аминогруппа данной аминокислоты вообще куда-то перемещается: может быть, на другую молекулу, может быть, удаляется в форме иона аммония (или аммиака). Процессы переноса аминогрупп были детально изучены акад. А. И. Браун штейном и его школой. Процесс переноса аминогруппы иногда сопровождается окислением (окислительное дезаминирование). Важную роль в этих реакциях играют ферменты, содержащие сложную активную группу (пиридоксальфосфат), в состав которой входит группа СНО.
С аминокислотами фермент образует связь (получается «шиффово основание») за счет реакции аминогруппы с группой СНО:
Смотря по тому, какой белок содержит данный фермент, шиффово основание может превратиться в те или иные конечные продукты. Так, например, под влиянием пиридоксальфосфата происходит перенос аминогруппы от глутаминовой кислоты на щавелевоуксусную и вместо исходной аминокислоты получаем кетоглутаровую кислоту СООН(СН 2)2 —СО—СООН.
Кетоглутаровая кислота участвует в цикле Кребса, и глутаминовая кислота из белка может включиться в цикл трикарбоновых кислот. Тот же фермент катализирует и обратную реакцию, так что из аспарагиновой кислоты может получиться щавелевоуксусная (тоже участвует и цикле Кребса, см. рис. в верху).
Примером окислительного дезаминирования может служить реакция, ускоряемая ферментами типа оксидаз аминокислот:
В клетках этот процесс превращения аминокислоты в простую карбоновую заканчивается реакцией разложения пероксида водорода под влиянием фермента. Аминокислоты, участвующие в процессах переноса (трансаминирования) и удаления аминогрупп (дезаминирование), в реакциях декарбоксилирования и рацемизации, являются одними из самых деятельных компонентов всех химических систем клетки.
Укажем некоторые наиболее типичные пути синтеза аминокислот.
Так, аспарагиновая кислота (ее соли — аспартаты) получается из щавелевоуксусной (ее соли оксалоацетаты) и какой-либо аминокислоты:
ССОН—СН2—СО—СООН + аминокислота → СООН— СН2—СН(NН2)СООН + кетокислота.
Из аспартатов в клетках образуются другие аминокислоты: треонин, метионин, лизин, а также амид-аспарагин.
Серии получается из 3-фосфо-D-глицериновой кислоты при участии НАД, фермента, переносящего аминогруппу (трансаминаза) и фермента фосфатазы.
Под влиянием фермента сериноксиметилазы серии образует глицин.
Одним из путей образования цистеина является реакция действия сероводорода на серии.
Помимо образования одной аминокислоты из другой, следует учитывать и возможности синтеза аминокислот за счет прямой ассимиляции аммиака. Так, из α-кетоглутарата и аммиака (иона аммония) получается глутамат. Реакция катализируется ферментом глутаматдегидрогеназой.
Ограничимся этими примерами и подведем краткий итог тому, что мы узнали о реакциях обмена веществ.
Важнейшие звенья этого комплекса реакций известны, поэтому почти вся схема будет понятна читателю. Исключение составляет только одно звено (крайнее левое), в котором из аспартата через ряд фосфорных производных углеводов образуются в конце концов аминокислоты фенилаланин, тирозин и триптофан; на одном из этапов этого же процесса получаются вещества, необходимые для синтеза гистидина, а также пиримидинов и пуринов. Мы, однако, не будем вдаваться в детали этого звена, а обратим внимание на всю картину в целом.
Прямоугольник (I) представляет реакции процесса гликолиза. Круг (II)—это цикл Кребса, справа от него (III)—дыхательная цепь, выше и справа — синтез жиров и фосфолипи дов, идущих на образование клеточных мембран. Сплошные линии показывают пути синтеза аминокислот. Как видно, аминокислоты получаются из пировиноградной кислоты (пируват), из оксалоацетата и α-кетоглутарата; фосфоглицериновая кислота (I) и фосфопируват (I) являются исходными веществами в синтезе аминокислот серина, цистеина, глицина, метионина. Через аспартат и оротовую кислоту
синтезируются гистидин, фенилаланин, тирозин и триптофан.
Наиболее важные, узловые аминокислоты названы на схеме полностью (глицин, глутамат, аспартат, треонин, метионии), остальные обозначены сокращенными названиями. Гликолиз (I) связан с циклом Кребса (II) через ацетил-КоА. Оба эти звена питают всю цепь синтеза аминокислот. Линии между I и V указывают пути синтеза нуклеиновых кислот. Эти кислоты получаются из пуринов и пиримидинов, в свою очередь связанных с аспартатом и глицином. Глицин и аминолевулиновая кисло та — сырье для синтеза важнейшего компонента дыхательной цепи — гема, на основе которого получаются цитохомы и активные группы различных окислительно-восстановительных ферментов.
Схема наглядно иллюстрирует исключительную роль аминокислот как при синтезе нуклеиновых кислот, так и в образовании ферментов дыхательной цепи. Вспомним, что именно дыхательная цепь и доставляет большую часть энергии, необходимой для синтезов, в форме энергии связей АТФ. Линии (III) и показывают путь синтеза АТФ из АДФ и Ф в результате работы дыхательной цепи и отчасти развития процесса гликолиза (I). Ацетил-КоА, как известно, выполняет работу по синтезу жирных кислот и жиров. Линии I и IV показывают (упрощенно) путь синтеза жиров и липидов.
Избыток глюкозы клетки могут превращать в гликоген (верхняя линия). Гликолен способен принимать участие (через образование фосфоглюкуроновой кислоты) в синтезе рибулозофосфата, отмеченного кружком (прямоугольник IV) и являющегося звеном в синтезе аминокислот (через шикимовую и фосфошикимовую кислоты). На схеме не указаны за недостатком места аммиак, требующийся в процессах аминирования, ионы железа, входящие в состав гема, и другие низкомолекулярные вещества.
Статья на тему Цикл Кребса
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Малеиновая и фумаровая кислоты
Эта кислота действительно существует в двух формах, известных под названиями малеиновой (цис-форма) и фумаровой (транс-форма) кислот. На примере этих кислот сторонники стереохимической гипотезы изомерии этиленовых соединений, а также и противники ее в многочисленном ряде исследований стремились найти доводы за и против этой гипотезы. Поэтому характерные черты взаимных отношений стереоизомерных кислот, а также их отношения к другим веществам, находящимся с ними в близкой генетической связи, наиболее подробно выяснены на этом примере.
Фумаровая кислота содержится во многих растениях; особенно часто она встречается в грибах. Название ее происходит от растения Fumaria officinalis (дымянка). Кроме того, фумаровая кислота получается особым брожением сахаристых веществ под действием Aspergillus fumaricus. Малеиновая кислота в природе не найдена.
Обе кислоты обыкновенно получаются при нагревании яблочной кислоты:
При медленном, осторожном нагревании получается главным образом фумаровая кислота, при более сильном нагревании и при перегонке яблочной кислоты — малеиновая кислота.
Малеиновая кислота часто образуется в результате окисления ненасыщенных циклических соединений, например бензохинона. В промышленном масштабе она может быть получена окислением бензола и нафталина кислородом воздуха в присутствии катализаторов (окись ванадия и др.).
Физические свойства и химические превращения фумаровой и малеиновой кислот являются чрезвычайно типичными для цис-транс-изомерии непредельных соединений. Отношения обеих кислот настолько характерны для этого вида изомерии, что они привели к установлению понятия о «фумароидных» и «малеиноидных» формах этиленовых изомеров.
Взаимные отношения фумаровой и малеиновой кислот чрезвычайно напоминают отношения устойчивых (стабильных) и неустойчивых (лабильных) полиморфных разностей. Устойчивая фумаровая кислота, образующая игольчатые кристаллы, имеет более высокую температуру плавления (в запаянном капилляре 287—288° С) и малую растворимость (растворимость, в воде при 16°С почти 1:150). Неустойчивая малеиновая кислота — ромбические призмы, плавящиеся при 130° С, — весьма легко растворима в воде (при обыкновенной температуре растворимость превышает 1:2).
Неустойчивость малеиновой кислоты проявляется в том, что очень часто вместо малеиновой кислоты из ее производных образуется фумаровая кислота. Так, например, это происходит при выделении кислоты из свинцовой соли малеиновой кислоты и других ее солей с тяжелыми металлами действием сероводорода. Кроме того, в присутствии следов иода (особенно на свету), следов азотистой кислоты и даже просто на свету малеиновая кислота превращается в фумаровую. Однако под действием ультрафиолетовых лучей фумаровая кислота может превращаться в малеиновую, что также характерно для всех неустойчивых соединений этого рода. Кроме того, фумаровая кислота при нагревании медленно отщепляет воду с образованием ангидрида малеиновой кислоты. Лучше происходит образование малеинового ангидрида при нагревании фумаровой кислоты с фосфорным ангидридом.
Характерно для отношений этих кислот также и то, что малеиновая кислота является значительно более сильной кислотой, чем фумаровая. Так, константы электролитической диссоциации первой карбоксильной группы К1=9,3 ∙ 10 –4 для фумаровой кислоты и K1=1,17 ∙ 10 –2 для малеиновой кислоты. Наоборот, константа диссоциации второй карбоксильной группы для фумаровой кислоты больше, чем для малеиновой, а именно: для фумаровой кислоты K2=2,9 ∙ 10 –5 , а для малеиновой кислоты K2=2,6 ∙ 10 –7 .
Химические свойства обеих кислот типичны для кислот, содержащих этиленовую связь в положении 1,2 (α, β) по отношению к карбоксилу. Так, уже амальгама натрия восстанавливает обе кислоты в янтарную кислоту.
Очень легко идет присоединение галоидоводорода, приводящее к образованию одной и той же оптически недеятельной (рацемической,) моногалоидзамещенной янтарной кислоты, например:
В результате присоединения воды под влиянием катализаторов образуется одна и та же недеятельная (рацемическая) яблочная кислота
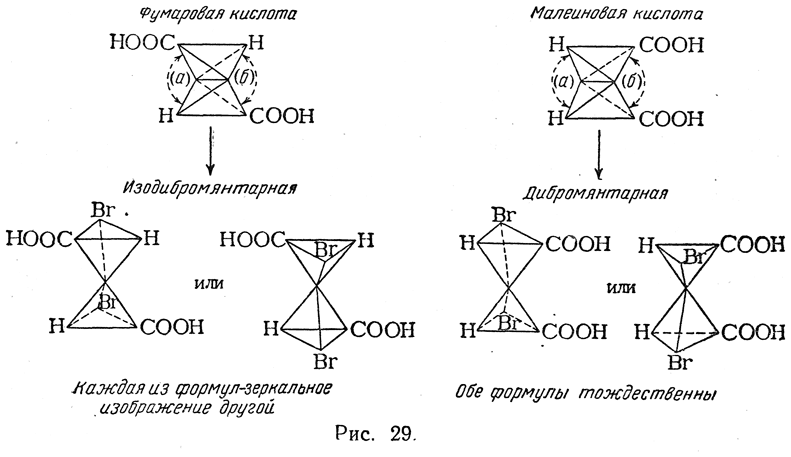
Присоединение двух одинаковых атомов или радикалов, например присоединение молекулы галоида или двух гидроксилов (при окислении перманганатом в щелочной среде), ведет к получению двух стереоизомерных недеятельных предельных соединений (рацемического и мезо-) с двумя асимметрическими атомами углерода, например двух дибромянтарных кислот
или двух диоксиянтарных (винных) кислот:
При реакциях присоединения малеиновая кислота в большинстве случаев предварительно частично переходит в фумаровую кислоту. Так, например, при присоединении брома к фумаровой кислоте получается труднорастворимая в воде дибромянтарная кислота, плавящаяся под давлением при 255° С, а из малеиновой кислоты получается легкорастворимая изодибромянтарная кислота с т. пл. 166° С (но также и дибромянтарная кислота вследствие образования фумаровой кислоты). Наоборот, при окислении перманганатом фумаровая кислота дает нормально виноградную кислоту, малеиновая — мезовинную кислоту.
Выбор пространственной конфигурации для малеиновой и фумаровой кислот основан на том, что легкого образования ангидрида можно ожидать лишь от цис-формы, у которой оба карбоксила пространственно близки друг к другу. При окислении циклических соединений, содержащих этиленовые связи, также можно ожидать образования цис-кислоты. На этом основании для малеиновой кислоты становится вероятной цис-конфигураахия, для фумаровой — транс-конфигурация. Это подтверждается отношением фумаровой и малеиновой кислот к винным кислотам.
Казалось бы, указанный выбор конфигураций можно подтвердить и на примере образования дибромянтарных кислот, однако присоединение брома к фумаровой кислоте и к малеиновому ангидриду (сама малеиновая кислота под действием брома изомеризуется в фумаровую) идет не так, как следовало бы ожидать.
Из фумаровой кислоты — безразлично, будет ли атакована двойная связь у (а) или у (б) (рис. 29), — должна была бы получиться рацемическая изодибромянтарная кислота, представляющая собой смесь равных количеств правовращающей и левовращающей кислот. Из малеиновой же кислоты должна получаться дибромянтарная кислота, у которой, как легко видеть, две половины молекулы являются зеркальными изображениями друг друга, и, следовательно, неизбежна полная внутримолекулярная компенсация асимметрии, т. е. должна получаться мезо-форма.
Фактически же при бромировании фумаровой кислоты получается высокоплавящаяся (256° С в запаянном капилляре) дибромянтарная кислота, которая, очевидно, должна быть мезо-формой, а при взаимодействии с бромом малеинового ангидрида (с последующим осторожным омылением) образуется низкоплавящаяся (169° С в открытом капилляре) изодибромянтарная кислота, которую удается разделить в виде солей с цинхонином или морфином на левовращающий и правовращающий изомеры, имеющие т. пл. 157° С. Таким образом из малеиновой кислоты образуется рацемическая смесь антиподов. Это указывает,
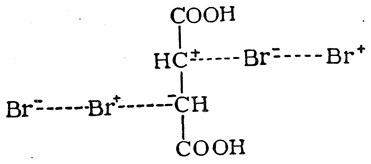
что механизм реакции бромирования сложнее, чем изображено на приведенной схеме. Очевидно, присоединение двух атомов брома происходит или не одновременно (ср. стр. 369), или через переходное состояние, в котором участвуют три молекулы:
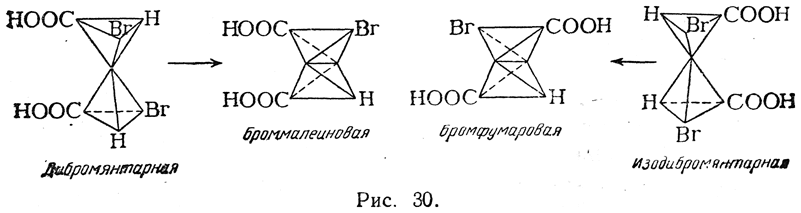
Гидролиз дибромянтарной кислоты дает мезовинную, а гидролиз изодибромянтарной — рацемическую винную кислоту, т. е. при этой реакции перегруппировка не происходит. При отщеплении же от дибромянтарной кислоты молекулы бромистого водорода образуется, по-видимому, броммалеиновая кислота, т. е. цис-кислота, поскольку она легко дает соответствующий ангидрид. Из изодибромянтарной кислоты получается бромфумаровая кислота (рис. 30):
Взаимные отношения бромфумаровой и броммалеиновой кислот напоминают отношения фумаровой и малеиновой кислот. Ангидрид бромфумаровой кислоты (как и фумаровой) неизвестен; в условиях, когда такой ангидрид должен был бы образоваться, получается ангидрид броммалеиновой кислоты Однако при восстановлении обеих кислот цинком и соляной кислотой в водном растворе получается только фумаровая кислота, возможно, вследствие того, что малеиновая кислота в этих условиях может изомеризоваться в фумаровую.
Бромфумаровая кислота при кипячении с водной щелочью гораздо легче отщепляет бромистый водород с образованием ацетилендикарбоновой кислоты, чем броммалеиновая кислота.
🎬 Видео
Мои Секреты. ЯНТАРНАЯ кислота . Как Растворить. Полезные Свойства.Скачать

То, что янтарная кислота творит с организмом, заслуживает уваженияСкачать

Янтарная кислота для подкормки растений. Готовим усиленный раствор!Скачать

Янтарная кислота. Как принимать янтарную кислоту? Отвечает Гузов И.И.Скачать

Янтарная кислота для орхидей || Способы применения янтарной кислоты и дозировкиСкачать

Вывод мочевой кислоты, Ксенобиотики и Янтарная кислота. Алименко А.Н. (29.05.2019)Скачать

Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

Кровь после янтарной кислотыСкачать

Не применяйте ЯНТАРНУЮ КИСЛОТУ в этих случаях! Как янтарная кислота может уничтожить растенияСкачать

Янтарная кислота - Эликсир здоровьяСкачать

Янтарная кислота для сильной рассады. Как правильно использовать янтарную кислоту для растений.Скачать

ОСТОРОЖНО, янтарная кислота! Как янтарная кислота может уничтожить урожайСкачать

Вы знали? Янтарная кислота добывается из янтаряСкачать

ЯНТАРНАЯ КИСЛОТА. Показания к применению и содержание в продуктахСкачать

Янтарная кислота для растенийСкачать

Тест с янтарной кислотой и особенности Вашей психики.Скачать

МНОГИЕ НЕ ЗНАЮТ!!! ЧТО У ЯНТАРНОЙ КИСЛОТЫ ТАКОЙ ШИРОКИЙ СПЕКТР ПРИМЕНЕНИЯ Бегом за Янтарной кислотойСкачать