Уравнение реакции, практически осуществимой в водном раст воре, имеет вид
Объект авторского права ООО «Легион»
- Вместе с этой задачей также решают:
- Уравнение реакции практически осуществимой в водном растворе имеет вид cuso4 2koh k2so4 cu
- Помогите пожалуйста : ) Укажите, какие из реакций могут протекать практически до конца : а) CuSO4 + KOH — > ; ?
- Напишите в молекулярном, полном и сокращенном ионном виде уравнения реакции согласно схеме CaCO₃ + HCI = NaOH + CuSO₄ = CaO + HNO₃ = BaCl₂ + Fe₂(SO₄)₃ = KOH + H₂SO₄ = Fe₂O₃ + HCI = AgNO₃ + CaCI₂ = Na₂?
- Попарно смешали растворы : 1) NaNo3 + K2So4 — 2) CH3COONa + HSO4 — 3) NaHCO3 + HCl — в каких из приведенных случаев реакции протекают практически необратимо, до конца?
- ОЧЕНЬ СРОЧНО?
- Составьте молекулярные и ионно — молекулярные уравнения реакций, протекающих при смешивании растворов Ca(OH)2 и FeCl2 ; CH3COOH и KOH ; CaCO3 и HCl ; CrCl3 и избыток KOH?
- Напишите молекулярные и ионные уравнения реакций : CO2 + KOH → , NiOHCl + HCl → ?
- Составить молекулярные, полные ионные и сокращённые ионные уравнения HCl + AgNO₃ ; BaCl₂ + CuSO₄?
- — Составьте молекулярное и ионное уравнения реакций, протекающих в растворе между следующими веществами ) K2CO3 и HCl ; б)CH3COOH и KOH?
- Опишите уравнения реакций, составьте полные и сокращенные ионные уравнения : А) HCl + KOH → Б) MgCl2 + NaOH →?
- Какая из реакций ионного обмена проходит в растворе практически до конца?
- ПОЖАЛУЙСТА?
- 🔍 Видео
Видео:CuSO4 + NaOH Взаимодействие сульфата меди (II) с гидроксидом натрия в водном раствореСкачать

Вместе с этой задачей также решают:
С раствором карбоната калия реагирует
- оксид магния
- сульфид меди(II)
- оксид углерода(II)
- азотная кислота
При взаимодействии 1 моль H2SO4 и 2 моль NaOH образуется
- средняя соль
- основная соль
- кислая соль
- вещества не реагируют
При взаимодействии 1 моль H2SO4 и 2 моль KOH образуется
- средняя соль
- основная соль
- кислая соль
- вещества не реагируют
С раствором хлорида железа(II) может реагировать
- угарный газ
- раствор серной кислоты
- раствор нитрата калия
- хлор
Видео:Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

Уравнение реакции практически осуществимой в водном растворе имеет вид cuso4 2koh k2so4 cu
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu 2 + + SO4 2- + 2Na + + 2OH — = 2Na + + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
2Al 3+ + 3SO4 2- + 3Ba 2+ + 6Cl — = 3BaSO4↓ + 2Al 3+ + 6Cl —
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + CO2↑ + H2O + 2Cl —
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K + + OH — + NH4 + + Cl — = K + + Cl — + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H + и CO3 2- .
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
6H + +2 PO4 3- + 6 K + + 3CO3 2- -> 6 K + + 2 PO4 3- + 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H + -> 6Na + + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H + -> 2Na + + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Помогите пожалуйста : ) Укажите, какие из реакций могут протекать практически до конца : а) CuSO4 + KOH — > ; ?
Химия | 5 — 9 классы
Помогите пожалуйста : ) Укажите, какие из реакций могут протекать практически до конца : а) CuSO4 + KOH — > ; .
Составьте уравнения этих рекций в молекулярной и сокращенной ионной формах.
CuSO₄ + 2 KOH ⇒Cu(OH)₂↓ + K₂SO₄ — молекулярное уравнение
Cu²⁺ + 2 OH⁻ ⇒ Cu(OH)₂↓ — краткое ионное уравнение
Реакция протекает практически до конца, потому что образуется осадок практически нерастворимого вещества — гидроксида меди Cu(OH)₂.
Из — за малой растворимости оно уже не можетвступатьв обратную реакцию, равновесие смещено вправо.
CaCO₃ + 2 HCl ⇒CaCl₂ + H₂O + CO₂↑CO₃²⁻ + 2 H⁺ ⇒ H₂O + CO₂↑Реакция протекает практически до конца, потому что образуется газообразное вещество — углекислый газ.
Газ улетучивается и в обратную реакцию не вступает.
Равновесие смещено вправо.
В)MgSO₄ + 2 NaF ⇒ MgF₂↓ + Na₂SO₄Mg²⁺ + 2 F⁻ ⇒ MgF₂↓
Реакция идет практически до конца, потому что образуется осадок практически нерастворимого вещества — фторид магния MgF₂.
Из — за малой растворимости оно уже не можетвступатьв обратную реакцию, равновесие смещено вправо.
2KOH + BaCl₂ ⇔Ba(OH)₂ + 2 KCl
В ходе этой реакции не образуются осадки или газы, поэтому будут протекать и прямая, и обратная реакции.
В равновесии будут находиться все возможные виды ионов :
2 K⁺ + 2 OH⁻ + Ba²⁺ + 2 Cl⁻ ⇔Ba²⁺ + 2 OH⁻ + 2 K⁺ + 2 Cl⁻
Для этой реакции возможно записать только полное ионное уравнение.
Краткого ионного уравнения нет, потому что все члены в полном уравнении сокращаются.
Однако надо учитывать, что растворимость гидроксида бария (3 г на 100 г воды) намного ниже, чем у остальных веществ (примерно в 10 раз, а по сравнению с KOH — почти в 40 раз).
Поэтому при высоких концентрациях исходных веществ — KOH иBaCl₂ — возможно выпадение осадка Ba(OH)₂.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Напишите в молекулярном, полном и сокращенном ионном виде уравнения реакции согласно схеме CaCO₃ + HCI = NaOH + CuSO₄ = CaO + HNO₃ = BaCl₂ + Fe₂(SO₄)₃ = KOH + H₂SO₄ = Fe₂O₃ + HCI = AgNO₃ + CaCI₂ = Na₂?
Напишите в молекулярном, полном и сокращенном ионном виде уравнения реакции согласно схеме CaCO₃ + HCI = NaOH + CuSO₄ = CaO + HNO₃ = BaCl₂ + Fe₂(SO₄)₃ = KOH + H₂SO₄ = Fe₂O₃ + HCI = AgNO₃ + CaCI₂ = Na₂CO₃ + HNO₃ =.
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Попарно смешали растворы : 1) NaNo3 + K2So4 — 2) CH3COONa + HSO4 — 3) NaHCO3 + HCl — в каких из приведенных случаев реакции протекают практически необратимо, до конца?
Попарно смешали растворы : 1) NaNo3 + K2So4 — 2) CH3COONa + HSO4 — 3) NaHCO3 + HCl — в каких из приведенных случаев реакции протекают практически необратимо, до конца?
Чем это можно объяснить для каждого из случаев?
Составьте полные и сокращенные ионно — молекулярные уравнения протекающих реакций.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

ОЧЕНЬ СРОЧНО?
Составить уравнения реакций : молекулярное уравнение, полное ионное уравнение, сокращенное ионное AgNo3 + KOH CuSo4 + KOH CaC03 + HCL KOH + финол фталеин + HCL H2S04 + мтил оранж + KOH.
Видео:Окислительно-восстановительные реакции в щелочноной среде. Упрощенный подход.Скачать

Составьте молекулярные и ионно — молекулярные уравнения реакций, протекающих при смешивании растворов Ca(OH)2 и FeCl2 ; CH3COOH и KOH ; CaCO3 и HCl ; CrCl3 и избыток KOH?
Составьте молекулярные и ионно — молекулярные уравнения реакций, протекающих при смешивании растворов Ca(OH)2 и FeCl2 ; CH3COOH и KOH ; CaCO3 и HCl ; CrCl3 и избыток KOH.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Напишите молекулярные и ионные уравнения реакций : CO2 + KOH → , NiOHCl + HCl → ?
Напишите молекулярные и ионные уравнения реакций : CO2 + KOH → , NiOHCl + HCl → ;
Видео:Решение ОВР методом полуреакцийСкачать

Составить молекулярные, полные ионные и сокращённые ионные уравнения HCl + AgNO₃ ; BaCl₂ + CuSO₄?
Составить молекулярные, полные ионные и сокращённые ионные уравнения HCl + AgNO₃ ; BaCl₂ + CuSO₄.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

— Составьте молекулярное и ионное уравнения реакций, протекающих в растворе между следующими веществами ) K2CO3 и HCl ; б)CH3COOH и KOH?
— Составьте молекулярное и ионное уравнения реакций, протекающих в растворе между следующими веществами ) K2CO3 и HCl ; б)CH3COOH и KOH.
Видео:ЛР-10-2-03 Определение коэффициента поверхностного натяжения методом отрыва капельСкачать

Опишите уравнения реакций, составьте полные и сокращенные ионные уравнения : А) HCl + KOH → Б) MgCl2 + NaOH →?
Опишите уравнения реакций, составьте полные и сокращенные ионные уравнения : А) HCl + KOH → Б) MgCl2 + NaOH →.
Видео:FeSO4+KMnO4+H2SO4=Fe2(SO4)3+MnSO4+K2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать
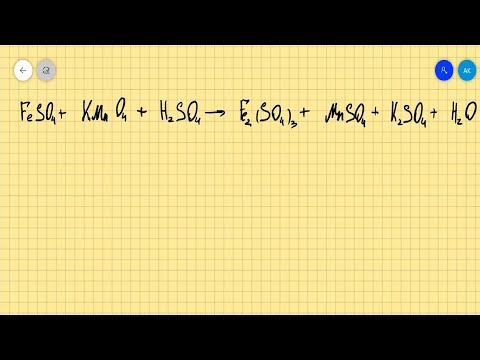
Какая из реакций ионного обмена проходит в растворе практически до конца?
Какая из реакций ионного обмена проходит в растворе практически до конца?
Ответ подтвердите уравнениями реакций в ионной и молекулярных формах :
Все числа — индексы.
Видео:Cu + HNO3 концентрированная - реакция ОВРСкачать

ПОЖАЛУЙСТА?
Составьте уравнение реакции в полном молекулярном, ионный и сокращенном ионных видах.
На странице вопроса Помогите пожалуйста : ) Укажите, какие из реакций могут протекать практически до конца : а) CuSO4 + KOH — > ; ? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
C7H16 — > C6H5CH3(толуол) + 4H2.
4. M(KNO3) = 39 + 14 + 16 * 3 = 101 g / mol M(MgSiO3) = 24 + 28 + 16 * 3 = 100 g / mol M(C2H5OH) = 12 * 2 + 1 * 5 + 16 + 1 = 46 g / mol 5. 2N2O5 — — >4NO2 + O2 — — разлож Mg + 2HCL — — >MgCL2 + H2 — — — замещ 4Na + O2 — — >2Na2O — — соед CuBr2 + 2Na..
4) Mr(KNO3) = 39 + 14 + 16 * 3 = 101 Mr(MgSiO3) = 24 + 28 + 16 * 3 = 100 Mr (C2H5OH) = 12 * 2 + 1 * 6 + 16 = 46 5) 2N2O5 — > 4NO2 + O2 реакция разложения Mg + 2HCl — > MgCl2 + H2 реакция замещения 4Na + O2 — > 2Na2O реакция соединения CuBr2 + 2NaOH -..
N(O) / n(K) = 10 m(K₃PO₄) = mw = n(K₃PO₄)M(K₃PO₄) = n(K)M(K₃PO₄) / 3 = n'(O)M(K₃PO₄) / 4 n(K) = 3mw / M(K₃PO₄) n'(O) = 4mw / M(K₃PO₄) m(H₂O) = m(1 — w) = n(H₂O)M(H₂O) = n»(O)M(H₂O) n»(O) = m(1 — w) / M(H₂O) / <3..
Что именно необходимо сделать с этими уравнениями? Расставить коэффициенты.
Ответ : 25 лДано : V(N₂) = 50 лV(NO) — ? Объяснение : N₂ + O₂ = 2NOИз уравнения реакции видно, что V(N₂) = 0, 5V(NO)V(N₂) = 0, 5 * 50 л = 25 лОтвет : 25 л.
Вот смотри и щас еще кинк.
Амфотерные — АL(OH)3, Zn(OH)2, Fe(OH)3. Основные — Ca(OH)2. Кислоты — H3SO4, HNO3. СТАВЬ СПАСИБО.
[Ca(NH₃)₃(H₂O)]Cl₂ хлорид акватриамминкальция.
🔍 Видео
Окислительно-восстановительные реакции. 1 часть. 10 класс.Скачать
Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Химия | Cкорость химической реакцииСкачать

Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать

Механизм реакций замещения | Химия ЕГЭ 10 класс | УмскулСкачать

ЛЕКЦИЯ №4 || Химическая кинетика || Методы определения порядка реакцииСкачать










