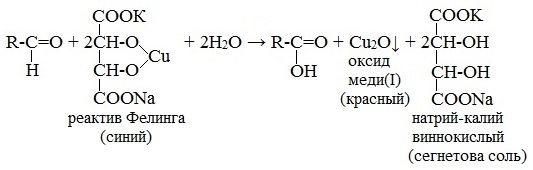
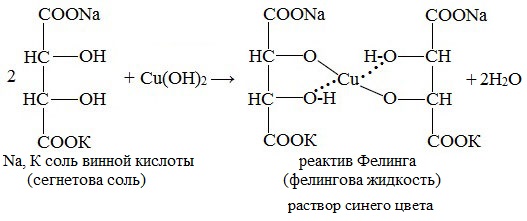
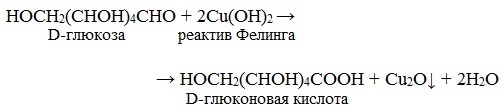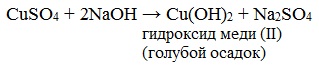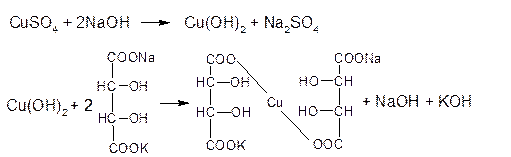Реактив Фелинга (медно-тартратный реактив, фелингова жидкость) — состоит из равных объемов раствора сложной соли тартрата натрия-калия (сегнетова соль, натрий-калий виннокислый) в 10%-ном р-ре NaOH и раствора сульфата меди.
Приготавливается непосредственно перед анализом путем смешения двух растворов.
Применяется для качественного и количественного определения альдегидов жирного ряда и в особенности моносахаридов. Действие реактива Фелинга основано на восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп исследуемых соединений.
При этом на холоде выпадает оранжево-жёлтый осадок гидроксида меди (I) СuОН, а при нагревании – красный осадок оксида меди (I) Сu2O.
Впервые был предложен в 1850 году немецким химиком Г. Фелингом.
Реакция на моносахариды
Глюкоза окисляется свежеосажденным гидроксидом меди (II) в щелочной среде до глюконовой кислоты, восстанавливая ионы Cu +2 до Cu +1 . Углеводы подобного типа называют восстанавливающими.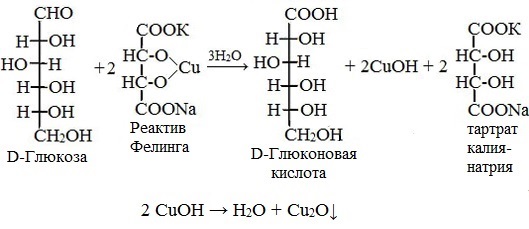
Эта реакция применяется для количественного определения сахаров в пищевых продуктах.
Реакция на альдегиды
Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную.
Ароматические альдегиды эту реакцию не дают.
Образование реактива Фелинга
Реактив Фелинга используется как качественная реакция для определения альдегидной группы.
Видео:Проба Фелинга на фенилпировиноградную кислотуСкачать

Углеводы. Фармацевтический анализ углеводов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
УГЛЕВОДЫ
Углеводы составляют обширную группу природных веществ, выполняющих в растительных и животных организмах разнообразные функции. Углеводы получают главным образом из растительных источников. Это связано с тем, что углеводы являются первичными продуктами фотосинтеза, осуществляемого растениями из оксида углерода и воды. Углеводы представляют своеобразный мост между неорганическими и органическими соединениями.
Название – «углеводы» возникло потому, что многие представители этого класса имеют общую формулу Сn(Н2О)m, и формально могут быть отнесены к «гидратам углерода».
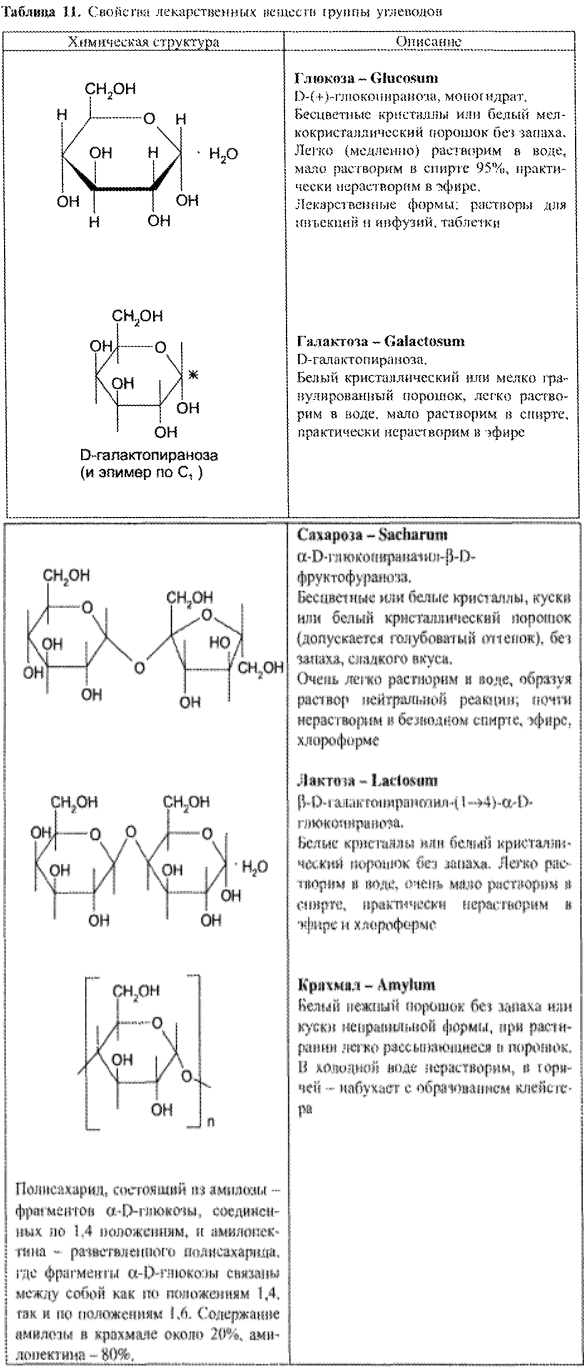
Наиболее значимым ЛС данной группы является глюкоза. К группе углеводов относятся также сахароза, лактоза, галактоза и крахмал (табл. 11).
Требования НД к качеству глюкозы как лекарственному средству соответствуют требованиям к химически чистым веществам. Характерными физическими свойствами глюкозы являются следующие: – определённая форма крупных или мелких кристаллов, оптическая активность с сильно выраженным вращением плоскости поляризации (удельное вращение 10% раствора глюкозы +52,3°), Тпл безводной глюкозы.
Для глюкозы, которую получают в виде моногидрата, количество кристаллизационной воды является показателем качества ЛС. Содержание кристаллизационной воды должно составлять 10% от массы глюкозы моногидрата.
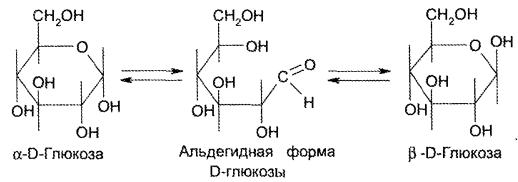
Определение удельного вращения глюкозы имеет свои особенности. В свежеприготовленных растворах глюкозы происходит мутаротация (изменение во времени величины угла вращения; через определенный временной интервал эта величина становится постоянной).
Мутаротацию можно ускорить путем прибавления к раствору глюкозы раствора аммиака (не более 0,1%). Если определять угол вращения глюкозы сразу после ее растворения и без прибавления к раствору аммиака, то этот показатель составит +109,16° и конечного значения +52,3° достигнет только через несколько часов.
Явление мутаротации объясняется тем, что при растворении глюкозы, которая в кристаллическом состоянии находится в какой-либо одной циклической форме, образуется ее альдегидная форма, через которую получаются аномерные циклические формы глюкозы: α и β – формы, различающиеся расположением полуацетального гидроксила относительно 1-го углеродного атома. Для α -D-глюкозы величина угла вращения составляет +109,6°, а для β-D-глюкозы +20,5°. Конечное значение угла вращения соответствует состоянию равновесия между α- и β – формами, которые через альдегидную форму в растворе превращаются друг в друга:
ХИМИЧЕСКИЕ СВОЙСТВА
Глюкоза и галактоза относятся к моносахаридам, сахароза и лактоза — к олигосахаридам, крахмал — к полисахаридам. Моносахариды, являясь веществами с двойственными функциями, вступают во многие реакции, характерные для спиртов и карбонильных соединений (альдегидов). Олигосахариды и полисахариды подвергаются гидролизу (ферментативному или кислотному) с образованием соответствующих моносахаридов.
Реакции на спиртовые гидроксилы
Как многоатомные спирты глюкоза, галактоза, сахароза и лактоза (подобно этиленгликолю и глицерину) способны взаимодействовать с меди (II) гидроксидом с образованием комплексных соединений синего цвета (химизм – см. с. 100).
Лекарственные вещества группы углеводов способны также к реакциям этерификации.
Реакции на альдегидную группу
Окисление, В зависимости от условий окисления моносахариды превращаются в различные продукты, В щелочной среде моносахариды окисляются под воздействием таких мягких окислителей, как реактивы Толленса и Фелинга (химизм – см. с, 107). С реактивом Толленса проходит реакция «серебряного зеркала», которая характерна для альдегидов. Следовательно, в эту реакцию моносахариды вступают в своей открытой (альдегидной) форме.
С реактивом Фелинга моносахариды образуют Сu2О красно-оранжевого цвета. И в этом случае моносахарид реагирует в открытой форме за счет альдегидной труппы. Обе реакции используются для обнаружения моносахаридов (например, глюкозы) в биологических жидкостях (кровь, моча).
Гликозиды и другие производные углеводов, не содержащие по- луацет:шьного гидроксила., не могут переходить в альдегидную форму и поэтому не обладают восстанавливающей способностью и не дают реакций с указанными реактивами.
В нейтральной среде окислению подвергается только альдегидная группа. При этом образуются альдоновые кислоты, которые в кислой среде, отщепляя воду, превращаются в лактоны.
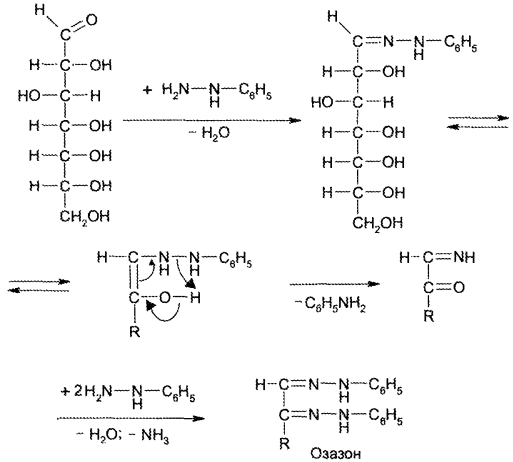
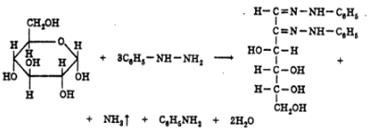
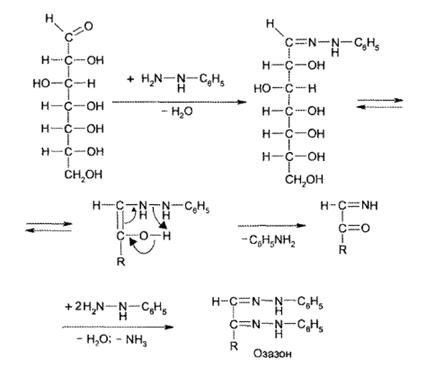
Образование озазонов. При нагревании моносахаридов с фенил- гидразином сахара превращаются в кристаллические соединения, плохо растворимые в воде, — озазоны. На 1-й стадии образуется фенилгидразон, который перегруппировывается в ходе внутримолекулярной окислительно-восстановительной реакции в моноимин 1,2-дикарбонильного соединения. Из последнего образуется озазон:
Озазоны — кристаллические вещества желтого цвета с четкой Тпл Реакция образования озазонов широко используется для установления подлинности сахаров, а также для выделения их из смесей.
АНАЛИЗ ИНДИВИДУАЛЬНЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Глюкоза (декстроза)
Подлинность. ФС в качестве испытания подлинности приводит реакцию окисления глюкозы реактивом Фелинга (химизм — см. с. 107).
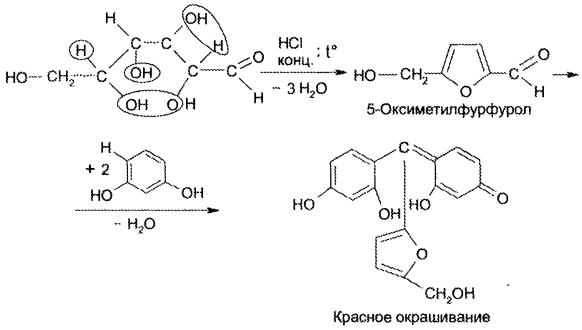
Известны и другие чувствительные и специфические реакции на глюкозу, не включенные в НД. Так, преобразование глюкозы в ме- тилфурфурол является чувствительной реакцией, которая основана на получении фурфурола из глюкозы при действии концентрированных серной или хлороводородной кислот с одновременным взаимодействием фурфурола с каким-либо фенолом (резорцином, тимолом, а-нафтолом) или ароматическим амином:
С меди (II) сульфатом глюкоза при подщелачивании (без нагревания!) образует растворимый фиолетово-синий комплекс; при стоянии раствора происходит окислительно- восстановительная реакция с выделением Сu2О. Таким образом, одновременно доказывается наличие и альдегидной, и спиртовых функциональных групп.
Регламентируется также определение удельного вращения. Измерение угла вращения проводят после прибавления к испытуемому раствору 2 капель раствора аммиака для предотвращения мутаротации.
Чистота, Статья ГФ на глюкозу включает стандартные испытания: прозрачность и цветность раствора, кислотность, присутствие хлоридов, сульфатов, кальция, бария, декстрина, мышьяка. Растворы для инъекций дополнительно проверяют на пирогенность.
Количественное определение. ГФ не регламентирует количественное определение субстанции. В препаратах глюкозы, в частности в растворах для инъекций, глюкозу определяют поляриметрически.
Сахароза
Сахароза является невосстанавливающим дисахаридом (олигосахаридом), так как образование гликозидной связи произошло за счет полуацетальных гидроксилов глюкозы и фруктозы. Поэтому сахароза не окисляется (в обычных условиях) реактивами Толленса и Фелинга. Сахароза — самый распространенный дисахарид, главный источник углеводов в пище человека. В фармации сахарозу применяют в виде сиропа — средство для улучшения вкуса.
Подлинность. Как многоатомный спирт сахароза образует с раствором кобальта (И) нитрата в присутствии эквивалентного количества натрия гидроксида комплекс фиолетового цвета.
Британская фармакопея (2001) регламентирует регистрацию ИК- спектра, а также ТСХ с использованием в качестве свидетелей стандартного образца сахарозы и других дисахаридов.
Чистота. Определение проводят так же, как у глюкозы.
Количественное определение не проводят.
Лактоза
Подлинность. У лактозы гликозидная связь образована между полуацетальным и спиртовым (С4) гидроксилами, поэтому подлинность лекарственного вещества доказывают прибавлением при нагревании реактива Фелинга. В результате выпадает кирпично-красный осадок меди (I) оксида (химизм — см. с. 107).
Чистота, Определение проводят так же, как у глюкозы.
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Характеристика химической активности углеводов.
В соответствии с наличием функциональных групп сахара дают реакции характерные для альдегидов и многоатомных спиртов. Однако существование сахаров в различных таутомерных формах приводит к тому, что эти реакции проводят в иных условиях.
Реакции на альдегидную группу
1.Реакции окисления( «серебряного зеркала»- (р-в Толленса) и реактивом Фелинга) – проводятся в тех же условиях, что и для альдегидов, но в присутствии очень малого количества щелочи (рН 7-8), т.к. избыток щелочи (рН 9-10) вызывает глубокие изменения в молекуле. Окисление в слабощелочной среде ведет у глюкозы к образованию глюконовой кислоты и окислению только по альдегидной группе:
 |  |
|




 | |
|
1) С реактивом Толленса (AgNO3 + 2NH4OH) при нагревании выпадает темный осадок серебра (глюкоза, галактоза, лактоза)
2) С реактивом Фелинга (глюкоза, галактоза, лактоза). При длительном стоянии или нагревании до кипения (по ФС) идет окислительно–восстановительная реакция с образованием кирпично-красного осадка Сu2O. (см. ФА альдегиды).
Комплекс синего цвета желтый
2CuOH↓ → Cu2O↓ + H2O
Желтый кирпично-красный осадок
2.Реакции конденсации. Окрашенные продукты конденсации получают при взаимодействии моносахаридов (или гидролизованных дисахаридов)
а) с раствором антрона в концентрированной серной кислоте. Появляется зеленое окрашивание, постепенно переходящее в сине-зеленое.
б) с трифенилтетразолия хлоридом (0,5%) в щелочной среде гидроксида натрия при нагревании только восстанавливающие сахара (глюкоза, галактоза, лактоза). Выпадает красный осадок трифенилформазана.
в) с фенилгидразином – реакция образования озазонов.
Растворы глюкозы, галактозы и лактозы образуют (альдегидная группа) выпадающие в осадок фенилгидразоны в кислой среде. При последующем нагревании на водяной бане в ходе перегруппировки и внутримолекулярной окислительно-восстановительной реакции получается окрашенный в желтый цвет осадок озазона.
Озазоны – кристаллические вещества с четкой Т°пл.
Реакция широко используется для установления подлинности восстанавливающих сахаров. Глюкоза взаимодействует с тремя молекулами фенилгидразина, а сахароза не дает положительной реакции.
Реакции на спиртовую группу
1. Реакции этерификации по спиртовому гидроксилу.
2. Как многоатомные спирты образуют в присутствии эквивалентного количества натрия гидроксида глюкоза, галактоза и лактоза с раствором меди (II) сульфата растворимый комплекс синего цвета, сахароза с раствором кобальта (II) нитрата комплекс фиолетового цвета.
💥 Видео
Качественная реакция на альдегиды с гидроксидом медиСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

25. Схема реакции и химическое уравнениеСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать

Классификация реакций: ионные и радикальные реакцииСкачать

Находим коэффициенты Химической Реакции с помощью Линейной Алгебры | ГДЕ МАТЕМАТИКА?Скачать

Общие свойства углеводов. Реактив Фелинга, Фруктоза, Сахароза, Крахмал.Скачать

Химические свойства альдегидов и кетонов. 11 класс.Скачать

Химия. 7 класс. Реакции разбавленных кислот с металлами /26.01.2021/Скачать

11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Именные реакции в органической химии | Химия ЕГЭСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Реакция с формальдегидомСкачать