- Ваш ответ
- решение вопроса
- Похожие вопросы
- Водорода оксид: получение и свойства
- Водород и его соединения
- Химические свойства водорода
- Вода — оксид водорода
- Строение молекулы воды
- Физические свойства оксида водорода
- Водорода оксид: химические свойства
- Распространение в природе
- Способы получения
- Биологическая роль
- Водород: химия водорода и его соединений
- Водород
- Положение в периодической системе химических элементов
- Электронное строение водорода
- Физические свойства
- Соединения водорода
- Способы получения
- Химические свойства
- Применение водорода
- Водородные соединения металлов
- Способы получения
- Химические свойства
- Летучие водородные соединения
- Строение и физические свойства
- Способы получения силана
- Способы получения аммиака
- Способы получения фосфина
- Способы получения сероводорода
- Химические свойства силана
- Химические свойства фосфина
- Химические свойства сероводорода
- Химические свойства прочих водородных соединений
- Физические свойства
- Химические свойства
- 📸 Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Ваш ответ
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

решение вопроса
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Водорода оксид: получение и свойства
Самое важное и распространенное на нашей планете вещество, безусловно, вода. Что может сравниться с ней по значимости? Известно, что жизнь на Земле стала возможна только с появлением жидкости. Что же собой представляет вода (оксид водорода) с химической точки зрения? Из чего состоит и какими свойствами обладает? Попробуем разобраться в данной статье.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Водород и его соединения
Самый легкий атом во всей периодической системе — водород. Он же занимает двойственное положение, располагаясь как в подгруппе галогенов, так и и первой группе щелочных металлов. Чем объясняются такие особенности? Электронным строением оболочки его атома. У него всего один электрон, который свободно может как уходить, так и присоединять себе еще один, формируя пару и завершая внешний уровень.
Именно поэтому основные и единственные степени окисления данного элемента +1 и -1. Он легко вступает во взаимодействие с металлами, образуя гидриды — твердые нелетучие солеподобные соединения белого цвета.
Однако также легко водород формирует и летучие молекулы веществ, взаимодействуя с неметаллами. Например:
В целом соединений водород формирует достаточно много. Однако самым важным веществом, в состав которого он входит, является оксид водорода, формула которого Н2О. Это самое известное соединение, которое узнает по формуле даже ученик начальных классов, еще не знакомый с химией. Ведь вода (а это и есть высший оксид водорода) — не только распространенное вещество, но и источник жизни на нашей планете.
Само название элемента отражает его главную сущность — водород, то есть «рождающий воду». Как и любой другой оксид, данный также является бинарным соединением, обладающим рядом физических, химических свойств. Кроме того, имеются и особые характеристики, отличающие воду от всех других соединений.
Также важным классом соединений, которые образует водород, являются кислоты, как органические, так и минеральные.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Химические свойства водорода
С точки зрения химической активности, водород — достаточно сильный восстановитель. Во многих реакциях он проявляет именно такие свойства. Однако при взаимодействии с еще более сильными металлами, он становится окислителем.
Очень важным в промышленности является взаимодействие водорода с оксидами металлов. Ведь это один из способов получения последних в чистом виде. Водородотермия — это металлургический метод синтеза чистых металлов из их оксидов путем восстановления водородом.
Реакция водорода с оксидом имеет следующий общий вид: MexOy + H2 = H2O + Me.
Конечно, это далеко не единственный способ синтеза чистых металлов. Существуют и другие. Однако восстановление оксидов водородом — энергетически достаточно выгодный и несложный производственный процесс, нашедший себе широкое применение.
Также интересна та особенность, что при смешении с воздухом газ водород способен образовывать сильно взрывчатую смесь. Ее название гремучий газ. Для этого смешивание следует производить из расчета два объема водорода на один кислорода.
Видео:Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Вода — оксид водорода
То, что данный оксид очень важный, мы уже несколько раз упомянули. Теперь давайте охарактеризуем его с точки зрения химии. Действительно ли данное соединение относится именно к этому классу неорганических веществ?
Для этого попробует немного иначе записать формулу: H2O = НОН. Суть та же, количество атомов прежнее, однако, теперь очевидно, что перед нами гидроксид. Какими свойствами должен он обладать? Рассмотрим диссоциацию соединения:
Следовательно, свойства кислотные, так как в растворе присутствуют катионы водорода. К тому же основными они быть не могут, ведь щелочи формируют только металлы.
Поэтому еще одно название, которое имеет водорода оксид — кислородсодержащая кислота самого простого состава. Раз такие сложные переплетения характерны для данной молекулы, следовательно, и свойства ее будут особенными. А свойства отталкиваются от строения молекулы, поэтому его и разберем.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

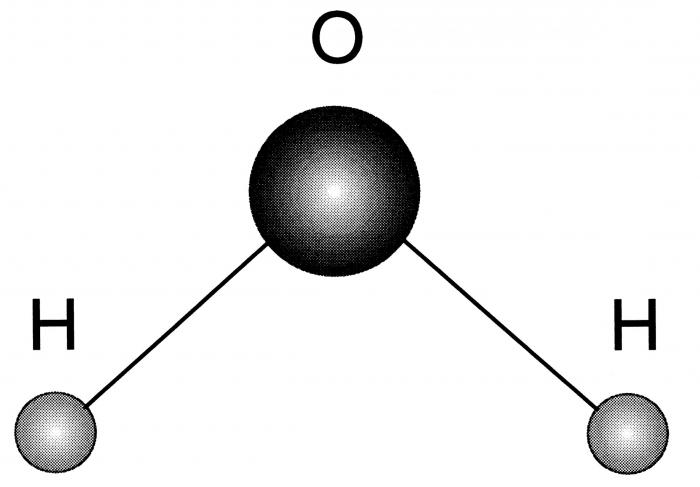
Строение молекулы воды
Впервые о данной модели задумался Нильс Бор, ему и принадлежит первенство и авторство в этом вопросе. Им были установлены следующие особенности.
- Молекула воды — диполь, так как элементы, входящие в ее состав сильно отличаются по значению электроотрицательности.
- Форма ее треугольная, в основании — водороды, а в вершине — кислород.
- Благодаря такому строению, данное вещество способно формировать водородные связи, как между одноименными молекулами, так и с другими соединениями, имеющими в составе сильно электроотрицательный элемент.
Посмотреть, как схематически выглядит рассматриваемый водорода оксид, можно на фото ниже.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Физические свойства оксида водорода
Можно обозначить несколько основных характеристических черт.
- Агрегатное состояние: газообразное — пар, жидкое, твердое — снег, лед.
- Температура кипения — 100 0 С (99,974).
- Температура плавления — 0 0 С.
- Вода способна сжиматься при нагревании в интервале температур от 0-4 0 С. Этим объясняется образование льда на поверхности, который имеет меньшую плотность и сохранение жизни под толщей оксида водорода.
- Высокое значение теплоемкости, однако очень низкая теплопроводность.
- В жидком состоянии водорода оксид проявляет вязкость.
- Особенным свойством можно назвать поверхностное натяжение и формирование отрицательного электропотенциала на поверхности воды.
Как мы отмечали выше, особенности свойств зависят от строения. Так и здесь. Способность формировать водородные связи привела к подобным чертам данного соединения.
Видео:ОВР в Органической химии. Как определить степени окисления и уравнять реакции?Скачать

Водорода оксид: химические свойства
С точки зрения химии, активность воды достаточно высока. Особенно если речь идет о реакциях, сопровождаемых нагреванием. С чем способен вступать во взаимодействие оксид водорода?
- С металлами, которые в ряду напряжений стоят до водорода. При этом с самыми активными (до алюминия) не нужны особые условия, а обладающие более низкой восстановительной способностью реагируют только с паром. Те же, что стоят после водорода, вообще не способны вступать в подобные взаимодействия.
- С неметаллами. Не со всеми, однако с большинством. Например, в атмосфере фтора вода сгорает фиолетовым пламенем. Также реакция возможна с хлором, углеродом, кремнием и другими атомами.
- С оксидами металлов (основными) и кислотными (неметаллов). Образуются, соответственно, щелочи и кислоты. Среди металлов к таким реакциям способны представители первых двух групп главных подгрупп, кроме магния и бериллия. Неметаллы, образующие кислотные оксиды, взаимодействуют с водой все. Исключением является речной песок — SiO2.
Уравнение реакций оксида водорода в качестве примера можно привести следующее: SO3 + H2O = H2SO4.
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Распространение в природе
Мы уже выяснили, что данное вещество — самое распространенное в мире. Обозначим процентное содержание в объектах.
- Около 70% от массы тела человека и млекопитающих животных. Некоторые представители фауны состоят из оксида водорода примерно на 98% (медузы).
- 71% Земли покрыт водой.
- Наибольшая масса составляет воды Мирового океана.
- Около 2% содержится в ледниках.
- 0,63% сосредоточено под землей.
- 0,001% приходится на атмосферу (туман).
- Тело растений состоит на 50% из воды, некоторых видов даже больше.
- Многие соединения встречаются в виде кристаллогидратов, содержащих связанную воду.
Продолжать данный список можно долго, ведь сложно вспомнить хоть что-нибудь, в состав чего не входит вода или когда-то не входила. Либо образовалось без участия этого оксида.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Способы получения
Получение оксида водорода промышленного значения не имеет. Ведь проще использовать готовые источники — реки, озера и прочие водоемы, чем затрачивать огромное количество энергии и реактивов. Поэтому в лаборатории уместно лишь получение дистиллированной, особо чистой воды.
Для этих целей используют определенные аппараты, такие как перегонные кубы. Такая вода необходима для проведения многих химических взаимодействий, так как неочищенная содержит большое количество посторонних примесей, солей, ионов.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Биологическая роль
Сказать, что вода используется везде, не сказать ничего. Немыслимо представить свою жизнь без этого соединения. С самого утра и до самой ночи человек постоянно использует его как в бытовых, так и промышленных целях.
Свойства оксида водорода подразумевают использование его как универсального растворителя. Причем не только в лаборатории. Но и в живых существах, где ежесекундно происходят тысячи биохимических реакций.
Также вода сама является участником многих синтезов, она же служит побочным продуктом, образующимся в результате них. Каждый человек на Земле за 60 лет пропускает через себя около 50 тонн этого удивительного вещества!
Оксид водорода используется:
- во всех отраслях промышленности;
- медицине;
- химических синтезах;
- во всех видах производств;
- бытовых нуждах;
- сельском хозяйстве.
Сложно определить область жизни, в которой можно обойтись без воды. Единственными живыми существами, не имеющими оксид водорода в своем составе и живущими без него, являются вирусы. Именно поэтому человеку сложно бороться с этими организмами.
Видео:Водород. 8 класс.Скачать

Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
📸 Видео
Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Водород/химические свойства водорода/8 классСкачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать