| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
- Химические свойства
- Соединения фосфора
- Фосфин (PH3)
- Фосфиды
- Оксид фосфора (III), триоксид фосфора (P2O3)
- Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
- Фосфорные кислоты
- Фосфористая кислота ( H3PO3)
- Соли фосфористой кислоты (Фосфиты)
- Ортофосфорная кислота, фосфорная кислота (Н3РO4)
- Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
- Фосфорные удобрения
- Р2О3 — кислотный оксид
- Р2О3 — очень сильный восстановитель
- Р2О5 — оксид фосфора (V)
- Способ получения
- Химические свойства
- Р2О5 — типичный кислотный оксид
- Р2О5 — водоотнимающий агент
- Фосфорные кислоты
- H3PO4 — фосфористая кислота
- Способы получения
- Физические свойства
- Химические свойства
- Кислотные функции
- Восстановительные свойства
- Восстановительные свойства
- Фосфиты — соли фосфористой кислоты
- Н3РO4 — ортофосфорная кислота
- Физические свойства
- Способы получения
- Химические свойства
- Кислотные функции
- Качественная реакция на анион РO4 3-
- Образование сложных эфиров
- Фосфаты. Фосфорные удобрения.
Видео:Оксиды фосфора. Строение, способы получения, свойства | ХимияСкачать

Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например , оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
2. Фосфорный ангидрид является типичным кислотным оксидом , взаимодействует с водой с образованием фосфорных кислот:
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями .
Например , оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Соединения фосфора
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
- Реакция диспропорционирования фосфора в щелочах:
- Разложение солей фосфония (Температура выше 80ºС):
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3 — Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
- С безводными кислотами образует соли:
- Окисляется кислородом. При Т
Практического значения фосфин не имеет.
Видео:9 класс. Урок 6. Оксиды фосфора.Скачать
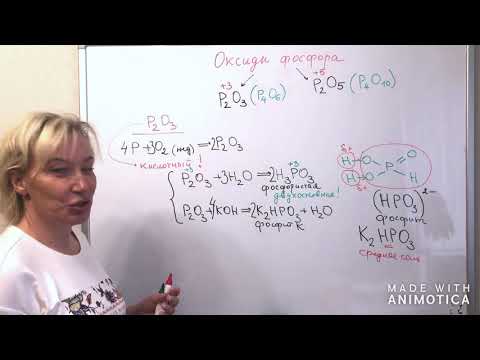
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Видео:Получение ортофосфорной кислоты!#химиядома#фосфорнаякислота#оксидфосфора5Скачать

Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3в горячей воде:
- При взаимодействии Р2О3с щелочами образуются соли фосфористой кислоты:
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Окисление галогенами:
Видео:Реакция оксида фосфора с водой. Химический опытСкачать

Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5 проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
- с основными оксидами, с образованием фосфатов
- с щелочами, с образованием средних и кислых солей
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Видео:Опыты по химии. Взаимодействие оксида фосфора (V) с водойСкачать

Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, в которых он находится в степенях окисления +5 и +3. Однако существует большое число кислот, в которых фосфор имеет валентность равную V (пять ковалентных связей) и степени окисления +5, +4, +3, +1.
Строение наиболее известных кислот выражается следующими формулами:
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
Видео:Горение КРАСНОГО ФОСФОРА. Химические опыты дома. Chemistry experience. Получение ОКСИДА ФОСФОРА.Скачать

Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
- Гидролиз галогенидов фосфора (III):
- Окисление белого фосфора хлором:
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
- Реагируют с более слабыми окислителями:
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
- взаимодействие фосфористой кислоты с металлами с выделением Н2
- взаимодействие фосфористой кислоты с оксидами металлов
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
- Взаимодействием фосфорного ангидрида с водой:
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
- с основными оксидами:
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
- с аммиаком образует соли аммония:
- Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислотыH2P2O7:
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Видео:Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO4 3- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO4 2- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4 — | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Р2О3 — кислотный оксид
Как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Но при растворении в горячей воде происходит очень бурная реакция диспропорционирования Р2О3:
Взаимодействие Р2О3 со щелочами приводит к образованию солей фосфористой кислоты:
Видео:Оксид фосфора(V). Фосфорные кислотыСкачать

Р2О3 — очень сильный восстановитель
1. Окисление кислородом воздуха:
2. Окисление галогенами:
Р2О5 — оксид фосфора (V)
При обычной температуре — белая снегоподобная масса, не имеет запаха, существует в виде димеров Р4О10. При соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Способ получения
Фосфорный ангидрид образуется в результате сжигания фосфора в избытке воздуха:
Химические свойства
Видео:Фосфор. 9 класс.Скачать

Р2О5 — типичный кислотный оксид
Как кислотный оксид Р2О5 взаимодействует:
а) с водой, образуя при этом различные кислоты
б) с основными оксидами, образуя фосфаты Р2О5 + ЗВаО = Ва3(PO4)2
в) со щелочами, образуя средние и кислые соли
Видео:оксид фосфора 3 ( молекула )Скачать

Р2О5 — водоотнимающий агент
Фосфорный ангидрид отнимает у других веществ не только гигроскопическую влагу, но и химически связанную воду. Он способен даже дегидратировать оксокислоты:
Это используется для получения ангидридов кислот.
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, но большое число кислот, в которых он находится в степенях окисления +5, +4, +3, +1. Строение наиболее известных кислот выражается следующими формулами
Как видно из этих формул, фосфор во всех случаях образует пять ковалентных связей, т.е. имеет валентность, равную V. В то же время степени окисления фосфора и основность кислот различаются.
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
H3PO4 — фосфористая кислота
Важная особенность фосфористой кислоты обусловлена строением ее молекул. Один из 3-х атомов водорода связан непосредственно с атомом фосфора, поэтому не способен к замещению атомами металла, вследствие чего эта кислота является двухосновной. Формулу фосфористой кислоты записывают с учетом этого факта следующим образом: Н2[НРО3]
Является слабой кислотой.
Способы получения
1. Растворение Р2О3 в воде (см. выше).
2. Гидролиз галогенидов фосфора (III): PCl3 + ЗН2О = Н2[НРО3] + 3HCl
3. Окисление белого фосфора хлором: 2Р + 3Cl2 + 6Н2О = 2Н2[НРО3] + 6HCl
Физические свойства
При обычной температуре H3PO3 — бесцветные кристаллы с т. пл. 74°С, хорошо растворимые в воде.
Химические свойства
Видео:Получение фосфорной кислоты из оксида фосфора 5Скачать

Кислотные функции
Фосфористая кислота проявляет все свойства, характерные для класса кислот: взаимодействует с металлами с выделением Н2; с оксидами металлов и со щелочами. При этом образуются одно — и двухзамещенные фосфиты, например:
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Восстановительные свойства
Кислота и ее соли — очень сильные восстановители; они вступают в окислительно-восстановительные реакции как с сильными окислителями (галогены, H2SО4 конц., К2Сr2O2), так и с достаточно слабыми (например, восстанавливают Au, Ag, Pt, Pd из растворов их солей). Фосфористая кислота при этом превращается в фосфорную.
При нагревании в воде Н3РO3 окисляется до H3PO4 с выделением водорода:
Видео:Способы получения оксидовСкачать

Восстановительные свойства
При нагревании безводной кислоты происходит диспропорционирование: 4Н3РO3 = ЗН3РO4 + РН3
Фосфиты — соли фосфористой кислоты
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2Р03.
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2- 1 анионами HPO3.
Большинство фосфитов плохо растворимы в во-де, хорошо растворяются только фосфиты щелочных металлов и кальция.
Н3РO4 — ортофосфорная кислота
3-основная кислота средней силы. Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Физические свойства
При обычной температуре безводная Н3РO4 представляет собой прозрачное кристаллическое вещество, очень гигроскопичное и легкоплавкое (т. пл. 42°’С). Смешивается с водой в любых соотношениях.
Способы получения
Исходным сырьем для промышленного получения Н3РO4 служит природный фосфат Са3(РO4)2:
I. 3-стадийный синтез:
II. Обменное разложение фосфорита серной кислотой
Получаемая по этому способу кислота загрязнена сульфатом кальция.
III. Окисление фосфора азотной кислотой (лабораторный способ):
Химические свойства
Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами, с основными оксидами и основаниями, образует соли аммония.
Видео:Химия 9 класс : Оксиды фосфораСкачать

Кислотные функции
в) со щелочами, образуя средние и кислые соли
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Качественная реакция на анион РO4 3-
Реактивом для обнаружения анионов РO4 3- (а также НРO4 2- , Н2РO4 — ) является раствор AgNO3, при добавлении которого образуется нерастворимый желтый фосфат серебра:
Образование сложных эфиров
Сложные эфиры нуклеозидов и фосфорной кислоты являются структурными фрагментами природных биополимеров — нуклеиновых кислот.
Фосфатные группы входят также в состав ферментов и витаминов.
Фосфаты. Фосфорные удобрения.
Н3РO4 как 3-основная кислота образует 3 типа солей, которые имеют большое практическое значение.
Растворимость в воде
большинство нерастворимо (кроме фосфатов щелочных Me и аммония)
