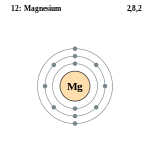
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
- Способ получения
- Качественная реакция
- Химические свойства
- Магний
- Содержание
- История открытия
- Изотопы
- Нахождение в природе
- Природные источники магния
- Получение
- Физические свойства
- Фазовый переход в сверхпроводящее состояние
- Химические свойства
- Применение
- Сплавы
- Химические источники тока
- Соединения
- Огнеупорные материалы
- Военное дело
- Медицина
- Фотография
- Аккумуляторы
- Производство
- Биологическая роль и токсикология
- Токсикология
- Биологическая роль
- Таблица нормы потребления магния
- Магний
- История
- Происхождение названия
- Получение
- Физические свойства
- Химические свойства
- Определение
- Применение
- Сплавы
- Химические источники тока
- Соединения
- Огнеупорные материалы
- Медицина
- Фотография
- Биологическая роль и токсикология
- Периодическая система химических элементов Менделеева
Видео:Получение оксида магния. Опыт 1Скачать

Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Видео:Получение оксида магния. Опыт 1Скачать

Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Магний
| Магний | |
|---|---|
| лёгкий, ковкий, серебристо-белый металл | |
 | |
| Название, символ, номер | Магний / Magnesium (Mg), 12 |
| Атомная масса (молярная масса) | [24,304; 24,307]а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s 2 |
| Радиус атома | 160 пм |
| Ковалентный радиус | 136 пм |
| Радиус иона | 66 (+2e) пм |
| Электроотрицательность | 1,31 (шкала Полинга) |
| Электродный потенциал | −2,37 В |
| Степени окисления | 0; +2 |
| Энергия ионизации (первый электрон) | 737,3 (7,64) кДж/моль (эВ) |
| Плотность (при н. у.) | 1,738 г/см³ |
| Температура плавления | 650 °C (923 K) |
| Температура кипения | 1090 °C (1363 K) |
| Уд. теплота плавления | 9,20 кДж/моль |
| Уд. теплота испарения | 131,8 кДж/моль |
| Молярная теплоёмкость | 24,90 Дж/(K·моль) |
| Молярный объём | 14,0 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=0,32029 нм, c=0,52000 нм |
| Отношение c/a | 1,624 |
| Температура Дебая | 318 K |
| Теплопроводность | (300 K) 156 Вт/(м·К) |
| Номер CAS | 7439-95-4 |
Магний — элемент второй группы (по старой классификации — главной подгруппы второй группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium ). Простое вещество магний — лёгкий, ковкий металл серебристо-белого цвета.
Видео:Получение карбоната магния и оксида магнияСкачать

Содержание
- 1 История открытия
- 2 Изотопы
- 3 Нахождение в природе
- 3.1 Природные источники магния
- 4 Получение
- 5 Физические свойства
- 5.1 Фазовый переход в сверхпроводящее состояние
- 6 Химические свойства
- 7 Применение
- 7.1 Сплавы
- 7.2 Химические источники тока
- 7.3 Соединения
- 7.4 Огнеупорные материалы
- 7.5 Военное дело
- 7.6 Медицина
- 7.7 Фотография
- 7.8 Аккумуляторы
- 8 Производство
- 9 Цены
- 10 Биологическая роль и токсикология
- 10.1 Токсикология
- 10.2 Биологическая роль
- 10.3 Таблица нормы потребления магния
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

История открытия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари назвали её «горькой солью», а также «английской» или «эпсомской солью». Минерал эпсомит представляет собой кристаллогидрат сульфата магния и имеет химическую формулу MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт выделил из белой магнезии восстановлением углём неизвестный металл, названный им австрием. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество было сильно загрязнено железом.
В 1808 г. английский химик Гемфри Дэви с помощью электролиза увлажнённой смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому дал название «магнезиум», сохранившееся до сих пор во многих странах. В России с 1831 года принято название «магний». В 1829 г. французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид металлическим калием. В 1830 г. М. Фарадей получил магний электролизом расплавленного хлорида магния.
Видео:Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

Изотопы
Природный магний состоит из смеси 3 стабильных изотопов 24 Mg, 25 Mg и 26 Mg с молярной концентрацией в смеси 78,6 %, 10,1 % и 11,3 % соответственно.
Все остальные 19 изотопов нестабильны, самый долгоживущий из них 28 Mg с периодом полураспада 20,915 часов.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Нахождение в природе
Кларк магния — 1,95 % (19,5 кг/т). Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде в виде раствора солей. Основные минералы с высоким массовым содержанием магния:
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения карналлита осадочного происхождения имеются во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относящихся к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они генетически связаны с карбонатными осадочными слоями и большинство из них имеет докембрийский или пермский геологический возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Чрезвычайно редким минералом является самородный магний, образующийся в потоках восстановительных газов и впервые обнаруженный в 1991 году в береговых отложениях Чоны (Восточная Сибирь), а затем в лавах в Южном Гиссаре (Таджикистан).
Природные источники магния
- Ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные карбонаты: доломит, магнезит).
- Морская вода.
- Рассолы (рапа соляных озёр).
В 1995 г. бо́льшая часть мирового производства магния была сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), на рынке возрастает доля Китая.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые удаляют примеси из магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции, вначале производят обжиг доломита:
Затем сильный нагрев с кремнием:
2MgO + CaO + Si → CaSiO3 + 2Mg
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта довольно прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Скорость воспламенения магния намного выше скорости одёргивания руки, поэтому при поджоге магния человек не успевает одёрнуть руку и получает ожог. На горящий магний желательно смотреть только через темные очки или стекло, так как в противном случае есть риск получить световой ожог сетчатки и на время ослепнуть.
Плотность магния при 20 °C — 1,738 г/см³, температура плавления 650 °C, температура кипения 1090 °C, теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Фазовый переход в сверхпроводящее состояние
При температуре Тс= 0,0005 К магний (Mg) переходит в сверхпроводящее состояние.
Видео:Решение упражнений по теме "Магний, щелочноземельные металлы и их соединения"Скачать

Химические свойства
При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и света:
Магний хорошо горит даже в углекислом газе:
2Mg + CO2 → 2MgO + C
Раскаленный магний энергично реагирует с водой, вследствие чего горящий магний нельзя тушить водой:
Mg + H2O → MgO + H2 + 75 kcal
Возможна также реакция:
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода:
Смесь порошка магния со взрывом реагирует с сильными окислителями, например с сухим перманганатом калия.
Также следует упомянуть реактивы Гриньяра, то есть алкил- или арилмагнийгалогениды:
RHal + Mg → (C2H5)2O RMgHal
Где Hal = I, Br, реже Cl.
Металлический магний — сильный восстановитель, применяется в промышленности для восстановления титана до металла из тетрахлорида титана и металлического урана из его тетрафторида
Видео:Вся неорганика для ЕГЭ и ОГЭ| Занятие №1Скачать

Применение
Используется для получения лёгких и сверхлёгких литейных сплавов (самолётостроение, производство автомобилей), а также в пиротехнике и военном деле для изготовления осветительных и зажигательных ракет. Со второй половины XX века магний в чистом виде и в составе сплава кремния с железом — ферросиликомагния, стал широко применяться в чугунолитейном производстве благодаря открытию его свойства влиять на форму графита в чугуне, что позволило создать новые уникальные конструкционные материалы для машиностроения — высокопрочный чугун (чугун с шаровидным графитом — ЧШГ и чугун с вермикулярной формой графита — ЧВГ), сочетающие в себе свойства чугуна и стали.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в космической, авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Из магниевого сплава изготавливались картеры двигателей бензопилы «Дружба» и автомобиля «Запорожец», ряда других машин. Сейчас из этого сплава производятся легкосплавные колёсные диски.
Химические источники тока
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства энергоёмких резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высокой ЭДС.
Соединения
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его компактного хранения и получения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO 4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с применением магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Военное дело
Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. В смеси с соответствующими окислителями он также является основным компонентом заряда светошумовых боеприпасов.
Медицина
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и соли магния традиционно применяются в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния). В то же время, использование солей магния в кардиологии при нормальном уровне ионов магния в крови является недостаточно обоснованным.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Аккумуляторы
Магниево-серные батареи являются одними из самых перспективных, теоретически превосходя ёмкость ионно-литиевых, однако пока эта технология находится на стадии лабораторных исследований в силу непреодолимости некоторых технических препятствий.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Производство
Производство в России сосредоточено на двух предприятиях: г. Соликамск (СМЗ) и г. Березники (АВИСМА). Общая производительность составляет, примерно, 35 тыс. тонн в год.
| Ранг | Страна | Производство (тыс тонн) |
|---|---|---|
| — | Весь мир | 6,970 |
| 1 | Китай | 4,900 |
| 2 | Россия | 400 |
| 3 | Турция | 300 |
| 4 | Испания | 280 |
| 5 | Австрия | 200 |
| 6 | Словакия | 200 |
| 7 | Бразилия | 150 |
| 8 | Австралия | 130 |
| 9 | Греция | 115 |
| 10 | КНДР | 80 |
| 11 | Индия | 60 |
| — | Другие страны | 150 |
Цены на магний в слитках в 2006 году составили в среднем 3 долл./кг. В 2012 году цены на магний составляли порядка 2,8—2,9 долл./кг.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Биологическая роль и токсикология
Токсикология
Соединения магния малотоксичны (за исключением солей таких ядовитых кислот, как синильная, азотистоводородная, плавиковая, хромовая).
Биологическая роль
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений (хлорофиллы). Его биологическая роль сформировалась исторически в период зарождения и развития протожизни на нашей планете в связи с тем, что солевой состав морской воды древней Земли был преимущественно хлоридно-магниевый, в отличие от нынешнего — хлоридно-натриевого.
Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатинфосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Магний необходим на всех этапах синтеза белка. Он участвует в поддержании нормальной функции нервной системы и мышцы сердца, оказывает сосудорасширяющее действие, стимулирует желчеотделение, повышает двигательную активность кишечника, что способствует выведению из организма холестерина.
Усвоению магния мешают наличие фитина и избыток жиров и кальция в пище. Недостаток магния в организме может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС). При потливости, частом употреблении слабительных и мочегонных, алкоголя, больших психических и физических нагрузках (в первую очередь при стрессах и у спортсменов) потребность в магнии увеличивается.
Более всего магния содержится в пшеничных отрубях, тыквенных семечках, какао-порошке. К пище, богатой магнием относят также кунжут, отруби, орехи. Однако обилие фитина в этих продуктах делает его малодоступным для усвоения, поэтому только зелёные овощи могут служить надёжным источником магния. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Суточная норма магния — порядка 300 мг для женщин и 400 мг для мужчин (предполагается, что всасывается около 30 % магния).
При употреблении витаминно-минеральных комплексов, содержащих магний, необходимо помнить, что при чрезмерном его потреблении возможна передозировка, сопровождающаяся снижением артериального давления, тошнотой, рвотой, угнетением центральной нервной системы, снижением рефлексов, изменениями на электрокардиограмме, угнетением дыхания, комой, остановкой сердца, параличом дыхания, анурическим синдромом.
Также следует соблюдать осторожность при приеме магния людям с почечной недостаточностью.
Таблица нормы потребления магния
| Пол | Возраст | Суточная норма потребления магния, мг/день | Верхний допустимый предел, мг/день |
|---|---|---|---|
| Младенцы | от 0 до 6 месяцев | 30 | Не определён |
| Младенцы | от 7 до 12 месяцев | 75 | Не определён |
| Дети | от 1 до 3 лет | 80 | 145 |
| Дети | от 4 до 8 лет | 130 | 240 |
| Дети | от 9 до 13 лет | 240 | 590 |
| Девушки | от 14 до 18 лет | 360 | 710 |
| Юноши | от 14 до 18 лет | 410 | 760 |
| Мужчины | от 19 до 30 лет | 400 | 750 |
| Мужчины | 31 год и старше | 420 | 770 |
| Женщины | от 19 до 30 лет | 310 | 660 |
| Женщины | 31 год и старше | 320 | 670 |
| Беременные женщины | от 14 до 18 лет | 400 | 750 |
| Беременные женщины | от 19 до 30 лет | 350 | 700 |
| Беременные женщины | 31 год и старше | 360 | 710 |
| Кормящие грудью женщины | от 14 до 18 лет | 360 | 710 |
| Кормящие грудью женщины | от 19 до 30 лет | 310 | 660 |
| Кормящие грудью женщины | 31 год и старше | 320 | 670 |
- Магний (Mg)
- Азид магния (Mg(N3)2) Тринитрид магний
- Алюминат магния (Mg(AlO2)2) Метаалюминат магния
- Амид магния (Mg(NH2)2)
- Антимонид магния (Mg3Sb2) Магний сурмянистый
- Арсенат магния (Mg3(AsO4)2) Магний мышьяковокислый
- Арсенид магния (Mg3As2) Магний мышьяковистый
- Аурат магния (Mg[AuO2]2)
- Ацетат магния (Mg(C2H3O2)2) Магний уксуснокислый
- Бензоат магния (Mg(C6H5COO)2) Магний бензойнокислый
- Борид магния (MgB2) Магний бористый
- Бромат магния (Mg(BrO3)2) Магний бромноватокислый
- Бромид магния (MgBr2) Магний бромистый
- Ванадат магния (Mg2V2O7) Магний ванадиевокислый
- Висмутид магния (Mg3Bi2)
- Вольфрамат магния (MgWO4) Магний вольфрамовокислый
- Гексаборид магния (MgB6) Бористый магний
- Гексафторогерманат магния (Mg[GeF6])
- Гексафторосиликат магния (MgSiF6)
- Гексацианоферрат II магния (Mg2[Fe(CN)6])
- Гептагидрат сульфата магния (MgSO4·7H2O) Английская соль
- Германид магния (Mg2Ge)
- Гидрид магния (MgH2) Магний водородистый
- Гидроарсенат магния (MgHAsO4)
- Гидрокарбонат магния (Mg(HCO3)2) Бикарбонат магния, Магний двууглекислый
- Гидрокарбонат магния-калия (MgKH(CO3)2)
- Гидроксид магния (Mg(OH)2) Гидроокись магний
- Гидроортофосфат магния (MgHPO4)
- Гипофосфит магния (Mg(PH2O2)2) Магний фосфорноватистокислый (Фосфинат магния)
- Глицерофосфат магния (MgC3H7O6P)
- Дигидроортофосфат магния (Mg(H2PO4)2)
- Дителлурид магния (MgTe2)
- Дифенилмагний (Mg(C6H5)2)
- Диэтилмагний (Mg(C2H5)2)
- Додекаборид магния (MgB12)
- Йодат магния (Mg(IO3)2) Магний йодноватокислый
- Йодид магния (MgI2) Магний йодистый
- Карбид магния (MgC2) Ацетиленид магния
- Карбонат магния (MgCO3) Магний углекислый
- Карбонат магния лекарственное средство
- Каустический магнезит
- Магнезит
- Метаборат магния (Mg(BO2)2) Магний борнокислый мета
- Метагерманат магния (MgGeO3) Магний германиевокислый
- Метасиликат магния (MgSiO3) Магний кремнекислый магний
- Метатитанат магния (MgTiO3) Магний титановокислый мета
- Молибдат магния (MgMoO4) Магний молибденовокислый
- Нитрат магния (Mg(NO3)2) Магний азотнокислый
- Нитрид магния (Mg3N2) Магний азотистый
- Нитрит магния (Mg(NO2)2) Магний азотистокислый
- Оксид магния (MgO) Магний окись (магнезия жженая)
- Оксалат магния (MgC2O4) Магний щавелевокислый
- Олеат магния (Mg(C18H33O2)2) Магний олеиновокислый
- Ортоарсенат магния (Mg3(AsO4)2)
- Ортоборат магния (Mg3(BO3)2)
- Ортосиликат магния (Mg2SiO4)
- Ортотитанат магния (Mg2TiO4)
- Перманганат магния (Mg(MnO4)2) Магний марганцовокислый
- Пероксид магния (MgO2) Перекись магния
- Перхлорат магния (Mg(ClO4)2) Магний хлорнокислый (Ангидрон)
- Пирофосфат магния (Mg2P2O7)
- Рицинолеат магния (Mg(C18H33O3)2) Магний рицинолевокислый
- Селенат магния (MgSeO4) Магний селеновокислый
- Селенид магния (MgSe) Магний селенистый
- Селенит магния (MgSeO3) Магний селенистокислый
- Силицид магния (Mg2Si) Магний кремнистый
- Станнид димагния (Mg2Sn)
- Стеарат магния (MgC36H70O4) Магний стеариновокислый
- Стекломагниевый лист
- Сульфат магния (MgSO4) Магний сернокислый
- Сульфид магния (MgS) Магний сернистый
- Сульфит магния (MgSO3) Магний сернистокислый
- Тартрат магния (MgC4H4O6) Магний виннокислый
- Теллурид магния (MgTe) Магний теллуристый
- Тиосульфат магния (MgS2O3) Гипосульфит магния
- Тиоцианат магния (Mg(SCN)2) Магний роданистый
- Трикарбид димагния (Mg2C3)
- Формиат магния (Mg(HCOO)2) Магний муравьинокислый
- Фосфат магния (Mg3(PO4)2) Магний Фосфорнокислый (Фосфат магния)
- Фосфид магния (Mg3P2) Магний фосфористый
- Фторид магния (MgF2) Магний фтористый
- Хлорат магния (Mg(ClO3)2) Магний хлорноватокислый
- Хлорид магния (MgCl2) Магний хлористый
- Хлорофилл
- Хлорофилл с1
- Хлорофилл с2
- Хлорофилл с3
- Хромат магния (MgCrO4) Магний хромовокислый
- Хромит магния (MgCr2O4) Магний хромистокислый
- Цирконат магния (MgZrO3) Магний циркониевокислый
- Цитрат магния (MgC6H6O7) Магний лимоннокислый
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Видео:7. Решение задач по химическим уравнениям. Как найти массу, объем и количество вещества по реакции?Скачать

Магний
| Магний | |
|---|---|
| Атомный номер | 12 |
| Внешний вид простого вещества |  |
лёгкий, ковкий, серебристо-белый металл
(молярная масса)
(первый электрон)
(по Полингу)
| Mg | 12 |
| 24,305 | |
| [Ne]3s 2 | |
| Магний | |
Магний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов , с атомным номером 12. Обозначается символом Mg Magnesium. Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
Видео:Получение осадка гидроксида магния | Mg2+ + 2OH- = Mg(OH)2Скачать

История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Видео:Получение ПЕРОКСИДА МАГНИЯ. Реакция ХЛОРИДА МАГНИЯ, ГИДРОКСИДА НАТРИЯ и ПЕРЕКИСИ ВОДОРОДА. ОпытыСкачать

Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1 % примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
2MgO + CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Видео:Оксиды магния и кальцияСкачать

Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. tпл = 650 °C, tкип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Видео:Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н2О = MgO + H2;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + H2;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Определение
Серебристо-белый, средний по твердости металл. Средне распространен в природе. При горении выделяется большое количество света и тепла.
Применение
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг.
Химические источники тока
Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др), и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др). ХИТ на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением. В последние годы в ряде стран обострилась проблема разработки аккумулятора с большим сроком службы, так как теоретические данные позволяют утверждать очень большие перспективы его широкого использования (высокая энергия, экологичность, доступность сырья).
Соединения
Гидрид магния — один из наиболее емких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Медицина
Оксид и соли магния применяется в медицине (аспаркам, сульфат магния, цитрат магния, минерал бишофит). Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — опорно-двигательного аппарата, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Поэтому магний является тем элементом, который контролирует энергетику организма. Магний необходим на всех этапах синтеза белка. Установлено также, что 80—90 % современных людей страдают от дефицита магния. Это может проявляться по-разному: бессоница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС) и прочие симптомы и болезни. А при частом употреблении слабительных, алкоголя, больших психических и физических нагрузках потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Для получения суточной нормы магния, порядка 300 мг для женщин и 400 мг для мужчин, необходимо выпивать 2—3 литра молока или съедать 1,5—2 кг мяса.
По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым магниесодержащим продуктом.
Установлено, что чтобы усвоить кальций, организму необходим магний. Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения.
Магний, Magnesium, Mg (12)
Название магнезия встречается уже в Лейденском папирусе-Х (Ш в.). Оно происходит, вероятно, от названия города в гористой местности Фессалии — Магнисия. Магнесийским камнем в древности назывались магнитная окись железа, а магнесом — магнит. Эти названия перешли в латинский и другие языки.
Внешнее сходство магнитной окиси железа с пиролизитом (двуокисью марганца) привело к тому, что магнезийским камнем, магнетисом и магне стали называть минералы и руды темной и темно-коричневой окраски, а в дальнейшем и другие минералы. В алхимической литературе слово магнес (Magnes) обозначало многие вещества, например ртуть, эфиопский камень, гераклийский камень. Минералы, rдержащие магний, тоже были известны с глубокой древности (доломит, тальк, асбест, нефрит и др.) и уже тогда находили широкое применение. Однако их считали не индивидуальными веществами, а видоизменениями других, более известных минералов, чаще всего извести.
Установить тот факт, что в магнийсодержащих минералах и солях присутствует особое металлическое основание, помогли исследования минеральной воды Эпсомского источника в Англии, открытого в 1618 г. Твердую соль из горькой эпсомской воды выделил в 1695 г. Грю, указав при этом, что по своей природе эта соль заметно отличается от всех других солей. В XVIII в. эпсомской солью занимались многие видные химики-аналитики — Бергман, Нейман, Блэк и др. Когда в континентальной Европе были открыты источники воды, подобной эпсомской, эти исследования расширились еще больше. По-видимому, Нейман первым предложил называть эпсомскую соль (карбонат магния) белой магнезией в отличие от черной магнезии (пиролюзита). Земля белой магнезии (Magnesia alba) под названием магнезия фигурирует в списке простых тел Лавуазье, причем синонимом этой земли Лавуазье считает «основание эпсомской соли» (base de sel d’Epsom).
В русской литературе начала XIX в. магнезия именовалась иногда горькоземом. В 1808 г. Дэви, подвергая белую магнезию электролизу, получил немного нечистого металлического магния; в чистом виде этот металл был получен Бусси в 1829 г. Вначале Дэви предложил назвать новый металл магнием (Magnium) в отличие от магнезии, которая в то время обозначала металлическое основание пиролюзита (Magnesium). Однако, когда название черной магнезии было изменено, Дэви предпочел называть металл магнезием. Интересно, что первоначальное название магний уцелело только в русском языке благодаря учебнику Гесса. В начале XIX в. предлагались и другие названия — магнезь (Страхов), магнезий, горькоземий (Щеглов).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда