Йодид серебра (AgI): строение, свойства, получение, применение — Наука
- Содержание:
- Состав
- Номенклатура
- Свойства
- Физическое состояние
- Молекулярный вес
- Температура плавления
- Точка кипения
- Плотность
- Растворимость
- Химические свойства
- Получение
- Использование в модификации погоды
- Побочные эффекты от этого использования
- Использование в фотографии
- Механизм действия
- Использование для удаления радиоактивного йода
- Другое использование
- Риски
- Ссылки
- Йодид серебра I
- Получение
- Acetyl
Видео:Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Содержание:
В йодид серебра Это неорганическое соединение, образованное атомом серебра (Ag) и атомом йода (I), валентность которого равна -1, а серебра — +1. Его химическая формула — AgI.
Это светло-желтое кристаллическое твердое вещество, которое темнеет при длительном воздействии света. Практически не растворяется в воде, но растворяется в присутствии высокой концентрации иодид-иона (I – ).
Поскольку он имеет кристаллическую структуру, похожую на лед, его использовали в качестве семян для производства дождя и изменения климата. Это использование подвергается сомнению из-за потенциального ущерба, который может вызвать AgI при растворении в воде.
С девятнадцатого века он использовался в фотографии из-за его способности затемнять светом. Он также используется в антимикробной терапии.
Его использование для удаления радиоактивного йода из отходов, образующихся при производстве ядерной энергии, было недавно изучено. Это полезно в оптических волокнах.
Это токсичное соединение для людей, животных и растений.
Видео:Получение фосфата и йодида серебраСкачать

Состав
Это ионное соединение, образованное серебром в степени окисления +1 и йодом с валентностью -1. Связь между двумя ионами очень прочная и стабильная.
Его кристаллическая структура зависит от температуры. Ниже 137 ° C он находится в кубической или гамма-форме (γ-AgI), между 137 и 145,8 ° C — это зеленовато-желтое твердое вещество или бета-форма (β-AgI) и выше 145,8 ° C. Он имеет желтый цвет и является его альфа-формой (α-AgI).
Видео:Реакции ионов серебра с 15ю анионами и растворимость осадков/ Reactions of 15 anions with silver(+)Скачать

Номенклатура
- Йодид серебра
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Свойства
Видео:"Золотой дождь". Получение кристаллов йодида свинца (химия)Скачать

Физическое состояние
Светло-желтые твердые, гексагональные или кубические кристаллы.
Видео:Качественная реакция на хлорид, бромид, йодид ион.Скачать

Молекулярный вес
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Температура плавления
Видео:ПОЛУЧЕНИЕ СЕРЕБРА. Выпадение Серебра С Помощью Окислительно-Восстановительной РеакцииСкачать

Точка кипения
Видео:Периодат Серебра - Ag3IO5. Реакция Дигидроортопериодата Натрия - Na3H2IO6 и Нитрата Серебра - AgNO3.Скачать

Плотность
Видео:Качественная реакция на ион трехвалентного железаСкачать

Растворимость
Практически не растворим в воде: 28 × 10-7 г / л при 25 ° C (0,0000028 г / л). Нерастворим в кислотах, кроме иодистоводородной кислоты (раствор йодоводорода в воде). Растворим в концентрированных растворах бромидов щелочных и хлоридов щелочных металлов.
Видео:Взаимодействие нитрата серебра и хлорида натрия. Химический опытСкачать

Химические свойства
Кислоты, концентрированные при высоких температурах (кипение), медленно атакуют его. Однако горячие растворы гидроксида щелочного металла на него не влияют.
Он растворяется в растворах, в которых есть избыток иодид-иона (I-), образуя комплекс йода и серебра.
Он чувствителен к свету, медленно темнеет, образуя металлическое серебро.
Видео:галогениды серебраСкачать

Получение
В природе он встречается в форме минерала йодаргирита, который является формой β-AgI.
В лаборатории его можно приготовить путем нагревания раствора нитрата серебра (AgNO3) с раствором щелочного йодида, например йодида калия (KI). AgI выпадает в осадок и промывается при отсутствии света кипящей водой.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Использование в модификации погоды
Он применяется к облакам для изменения количества или типа осадков, запуска процессов града, рассеивания холодных туманов и ослабления ураганов.
Он рассеивается в виде семян в холодных облаках, содержащих переохлажденную жидкую воду (температура ниже 0 ° C). Его кристаллическая структура, похожая на лед, способствует замерзанию переохлажденной воды.
Видео:Тетраиодовисмутат(3) Калия - K[BiI4]. Реакция Йодида Висмута(3) и Йодида Калия. Реакция BiI3 и KI.Скачать
![Тетраиодовисмутат(3) Калия - K[BiI4]. Реакция Йодида Висмута(3) и Йодида Калия. Реакция BiI3 и KI.](https://i.ytimg.com/vi/m-2Bl1EdD-k/0.jpg)
Побочные эффекты от этого использования
После рассеивания в виде семени в облаках AgI обнаруживается внутри облака и смывается осадками.
Присутствие растворимого йодида серебра в дождевой воде следует принимать во внимание, поскольку это токсичное соединение для водных, наземных и человеческих растений и животных.
Повторное засеивание облаков на одной и той же площади может привести к кумулятивному эффекту этого соединения. Агентство по охране окружающей среды или EPA Агенство по Защите Окружающей Среды) считает AgI загрязнителем воды и почвы.
Согласно исследованиям, проведенным в 2013 году, концентрация йодида серебра, обнаруженная в районах, где использовался этот метод, намного превышает предел, выше которого он токсичен для некоторых рыб и низших организмов.
Видео:Нитрат Йода(3) - I(NO3)3. Реакция Спиртового раствора Йода и Нитрата Серебра. Реакция I2 и AgNO3.Скачать

Использование в фотографии
AgI — это материал, способный реагировать в присутствии света, поэтому он используется для получения светочувствительных материалов, таких как фотографические ролики, на которые наносятся его кристаллы.
Размер этих кристаллов, также называемых зернами, определяет величину светочувствительности. Чем больше размер зерна, тем выше светочувствительность и, следовательно, меньше его требуется для захвата изображения.
Фотобумага имеет тонкий слой желатина, в котором взвешены зерна AgI.
Видео:Получение ацетиленида серебраСкачать

Механизм действия
Кристаллическая структура этого соединения такова, что оно допускает определенное движение электронов, поэтому, когда фотон ударяется о кристалл или ударяется о кристалл, высвобождается электрон, который объединяется с соседним ионом серебра с образованием металлического серебра (Ag 0 ).
Кристалл AgI + фотон → e –
Эффект фотонов на фотоэмульсии заключается в восстановлении иона серебра до металлического серебра, образуя скрытое изображение, которое невидимо невооруженным глазом, но имеет скрытые различия в яркости захваченной сцены.
То есть некоторые области фотопленки получили фотоны, а другие — нет. Чтобы эмульсия не продолжала реагировать, материал защищают от воздействия света, а затем добавляют химические соединения, чтобы зафиксировать изображение и сделать его видимым.
Серебряный металл из-за своего цвета создает темные участки.
Хотя сегодня мы можем быстро получать фотографические изображения с помощью наших смартфонов, процессы химической фотографии по-прежнему являются фундаментальной частью кинематографической пленки и рентгеновской пленки, среди других приложений.
Видео:Цветные осадки и другие признаки протекания реакции.Скачать
Использование для удаления радиоактивного йода
Из-за нерастворимости AgI был предложен механизм удаления йода или радиоактивного йодида, содержащегося в водных отходах, образующихся на атомных электростанциях.
Согласно исследованиям, проведенным в 2019 году, наночастицы серебра с цеолитом обладают способностью удалять йод из воды. В присутствии воды наночастицы Ag, содержащиеся в цеолите, окисляются с образованием Ag2Или тогда генерируется ион Ag + который связывается с йодидом и осаждает AgI на поверхности цеолита.
Видео:Получение СЕРЕБРА из нитрата серебра. Реакция МЕДИ и НИТРАТА СЕРЕБРА. Опыты по химии.Getting SILVER.Скачать

Другое использование
Он использовался для лечения инфекций слизистых оболочек животных в виде коллоидных суспензий с 5-49% по весу. В ситуациях воспаления глаз, ушей и носа применяется в виде мази или мази на 5%.
Наночастицы AgI использовались в качестве средств противомикробной терапии. В химических и биохимических лабораториях он используется как реагент и служит промежуточным звеном при получении других соединений серебра и йода.
Он был изучен физиками на предмет наличия механизма проводимости электричества в виде жидкой решетки. Он используется в оптических волокнах для инфракрасных лазеров, так как он прозрачен в средней и инфракрасной областях светового спектра.
Видео:Йодид Ртути(1) - Hg2I2. Реакция Ртути И спиртового раствора Йода. Реакция Hg и I2.Скачать

Риски
Он токсичен для людей при всех путях, таких как кожный контакт, вдыхание и проглатывание. Он вызывает кожную сыпь, конъюнктивит, сероватое изменение цвета кожи, конъюнктивы и внутренних органов, головную боль, лихорадку, ларингит и бронхит.
Взаимодействие с соединениями меди может увеличить мутагенный потенциал AgI.
Это очень токсичное соединение для водных и наземных организмов, как животных, так и растений. Его вредное воздействие может сохраняться в окружающей среде.
Видео:Качественные реакции на галогенид ионыСкачать

Ссылки
- НАС. Национальная медицинская библиотека. (2019). Иодид серебра. Получено с pubchem.ncbi.nlm.nih.gov.
- Курик, М. и Янк, Д. (2013). Влажное отложение посевного агента после мероприятий по изменению погодных условий. Environ Sci Pollut Res 20, 6344-6350 (2013). Восстановлено с link.springer.com.
- Виттен, Н. (2016). Химия фотографии. Старшая диссертация. Университет Южной Каролины. Колумбия. Восстановлено с scholarcommons.sc.edu.
- Лиде, Д. (редактор) (2003). CRC Справочник по химии и физике. 85 th CRC Press.
- Тауанов З., Инглезакис В. (2019). Удаление йодида из воды с помощью синтетических цеолитов, импрегнированных наночастицами серебра. Наука об окружающей среде в целом 682 (2019) 259-270. Восстановлено с sciencedirect.com.
- Фонд Викимедиа. (2020). Иодид серебра. Восстановлено с en.wikipedia.org.
- Мацуура, Ю. (2013). Оптические волокна для медицинских приложений. В лазерах для медицинских приложений. Восстановлено с sciencedirect.com.
Как мотивировать команду на работе: 8 советов
Картографическая коническая проекция: характеристики, достоинства, недостатки
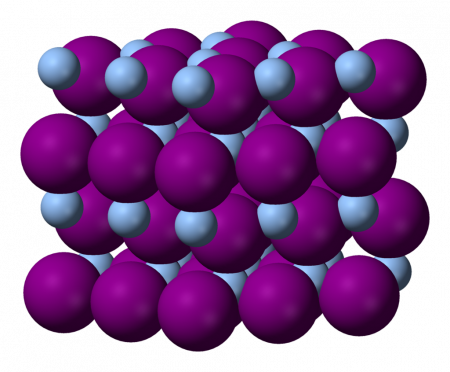
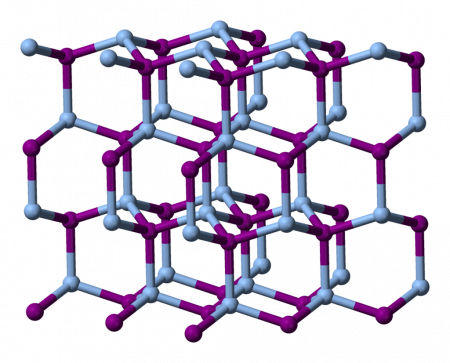
Йодид серебра I
| Йодид серебра I | |
|---|---|
  | |
| Хим. формула | AgI |
| Рац. формула | AgI |
| Молярная масса | 234.77 г/моль |
| Плотность | 5.675 г/см³ |
| Температура | |
| • плавления | 558 °C |
| • кипения | 1506 °C |
| Энтальпия | |
| • образования | −62,4 кДж/моль |
| Рег. номер CAS | 7783-96-2 |
| PubChem | 24563 |
| Рег. номер EINECS | 232-038-0 |
| SMILES | |
| Номер ООН | 3077 |
| ChemSpider | 22969 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Йодид серебра (Йодистое серебро) — неорганическое соединение с формулой AgI. Это жёлтое вещество, чувствительное к действию света, используется в фотографии, находит применение в качестве антисептика в медицине, а также в качестве дождеобразующего реагента.
Йодид серебра практически не растворяется в воде благодаря своей кристаллической структуре. Она существует в трёх известных разновидностях, меняющихся с изменением температуры.
Одна из них очень схожа по строению с таковой у льда, поэтому введение небольшого количества йодида вызывает образование очагов конденсации в облаках, тем самым вызывая выпадение осадков. По некоторым оценкам, для этой цели используется около 50 тонн вещества в год — при том, что однократно расходуется от 10 до 50 граммов.
Йодид серебра токсичен, при контакте или вдыхании концентрированных паров возможно отравление. Симптомы: головная боль, слабость, анемия, потеря веса, раздражение слизистых оболочек. При длительном контакте или вдыхании может развиться аргирия.
Получение
При комнатной температуре, воздействием йодоводородом или йодидом калия или йодидом натрия на нитрат серебра, йодид серебра выпадет в осадок.
AgNO3 + HI ⟶ AgI ↓ + HNO3 , AgNO3 + KI ⟶ AgI ↓ + KNO3 , AgNO3 + NaI ⟶ AgI ↓ + NaNO3
Медная пластина, покрытая тонким слоем серебра, тщательно отполированная до зеркального блеска, помещается в специальный ящик, полированной стороной вниз. Снизу ящика под пластиной помещается чашка с кристаллическим йодом. При подогреве йод начинает возгоняться и пары его сублимируются на полированной серебряной пластине. Йод вступает в реакцию с серебром, и пластина покрывается тонким слоем йодистого серебра, становясь светочувствительной. Дагеротипия
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. |



