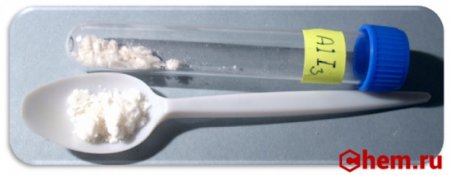
Галогены и металлы активно взаимодействуют. Пример — реакция соединения йода с алюминием.
Порошок алюминия смешаем с порошком йода. Реакция не идет. Плотная окисная пленка на алюминии тормозит процесс. Добавим катализатор — капельку воды — начинается бурная реакция. Вода взаимодействует с йодом, образовавшиеся йодсодержащие кислоты растворяют защитную окисную пленку алюминия – металл начинает бурно реагировать с йодом. Реакция проходит с выделением теплоты, поэтому непрореагировавший йод нагревается и возгоняется ‑ образуются фиолетовые пары йода
Оборудование: фарфоровые чашка и ступка, стальная пластинка, шпатель, пипетка.
Техника безопасности . Опыт необходимо проводить под тягой.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
- Алюминий. Химия алюминия и его соединений
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Йодид алюминия
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
- Токсичность
- 📺 Видео
Видео:Химическая реакция йода и алюминия.Скачать

Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Видео:Получение иодида алюминия | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Йодид алюминия
| Йодид алюминия | |
|---|---|
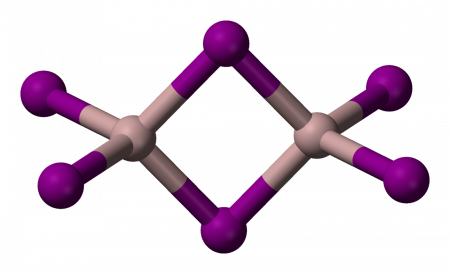 | |
| Систематическое название | Йодид алюминия |
| Химическая формула | AlI3 |
| Внешний вид | кристаллическое вещество белого цвета с желтоватым оттенком |
| Молярная масса | 407,69 г/моль |
| Температура плавления | 188.3 °C (461,45 К) |
| Температура кипения | 382.5 °C (655,65 К) |
| Плотность | 3,98 г/см³ |
| Константа диссоциации pKa | 1) 5,02 2) 5,33 3) 5,87 4) 7,50 |
| Давление пара | 1 мм рт. ст. (178 °C) 10 мм рт. ст. (225 °C) 100 мм рт. ст. (296 °C) |
| Кристаллическая решётка | гексагональная |
| Стандартная энтальпия образования | −308 кДж/моль |
| Энтальпия плавления | +15,9 кДж/моль |
| Стандартная молярная энтропия | +190 Дж/(моль·К) |
| Стандартная энергия образования Гиббса | −304 кДж/моль |
| Регистрационный номер CAS | 7784-23-8 |
| Регистрационный номер EC | 232-054-8 |
| R-фразы | R14 ; R34 ; R40 ; R42/43 |
| S-фразы | S22 ; S26 ; S36/37/39 ; S45 |
| H-фразы | H314; H317 |
| P-фразы | P280; P305 + P351 + P338; P310 |
| Пиктограммы опасности |    |
| Пиктограммы опасности СГС |   |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Йодид алюминия (Алюминий йодистый) — неорганическое вещество с химической формулой AlI3 . Относится к классу бинарных соединений, также может рассматриваться как соль алюминия и йодоводородной кислоты. Твердое вещество белого цвета с желтоватым оттенком.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Токсичность
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Физические свойства
Безводный йодид алюминия при нормальных условиях — белое кристаллическое вещество с гексагональной сингонией кристаллической решётки. Плавится и кипит без разложения, гигроскопичен. Образует кристаллогидрат состава AlI3 ⋅ 6 H2O светло-жёлтого цвета. Кристаллогидрат хорошо растворим в воде, растворим в этаноле, эфире, сероуглероде.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства
Йодид алюминия обладает следующими химическими свойствами.
- Реагирует с концентрированной серной кислотой:
8 AlI3 + 15 H2SO4 ⟶ 4 Al2(SO4)3 + 12 I2 ↓ + 3 H2S ↑ + 12 H2O
- При поглощении влаги воздуха частично разлагается с образованием осно́вной соли, та же соль образуется при нагревании кристаллогидрата:
AlI3 + 2 H2O ⟶ Al(OH)2I + 2 HI ↑ AlI3 ⋅ 6 H2O → >185∘C Al(OH)2I + 2 HI + 4 H2O
- При нагревании раствора йодида алюминия выпадает осадок гидроксида алюминия:
AlI3 + 3 H2O ⟶ Al(OH)3 ↓ + 3 HI ↑
- В газовой фазе при температуре выше 250 °C происходит частичная димеризация:
2 AlI3 ⇄ Al2I6
- Кроме того, йодид алюминия обладает всеми свойствами, общими для растворимых солей алюминия:
- при растворении в воде происходит диссоциация, сопровождающаяся гидратацией и последующим многоступенчатым гидролизом катиона; при этом создаётся кислотная среда, в частности, для первой ступени гидролиза константа кислотности равна
Ka1 = [Al(H2O)5(OH) 2+ ] ⋅ [H3O + ][Al(H2O)6 3+ ] = 9,55 ⋅ 10 −6
- с разбавленными щелочами образует осадок гидроксида алюминия, с концентрированными разлагается с образованием тетрагидроксоалюмината
AlI3 + 3 OH − ⟶ Al(OH)3 ↓ + 3I − AlI3 + 4 OH − ⟶ [Al(OH)4] − + 3I −
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
Йодид алюминия может быть получен непосредственно реакцией порошкообразного алюминия и йода (для реакции необходимо небольшое количество воды в качестве катализатора — образующиеся при реакции йода с водой кислоты растворяют покрывающую алюминий оксидную плёнку, ускоряя реакцию):
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Применение
Видео:8 класс. Составление уравнений химических реакций.Скачать

Токсичность
Йодид алюминия токсичен, способен вызывать ожоги кожи и слизистых оболочек (глаз, органов дыхания, ЖКТ). Может вызывать аллергические реакции.
📺 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Химия 9 класс (Урок№25 - Алюминий. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.)Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Химия 9 класс: АлюминийСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Качественная реакция ионов алюминия с гидрофосфатом натрияСкачать

9 и 11 классы. Алюминий. Часть 1.Скачать

Уравнивание реакций горения углеводородовСкачать

Йодид Меди(1) - CuI. Реакция Йодида Калия(KI), Сульфита Натрия(Na2SO3) и Сульфата Меди(CuSO4)Скачать