Хлорид свинца: свойства, строение, применение — Наука
- Содержание:
- Свойства
- -Хлорид свинца (II)
- Молярная масса
- Внешность
- Плотность
- Температура плавления
- Точка кипения
- Растворимость воды
- Показатель преломления
- Свинец (IV) хлорид
- Молярная масса
- Внешность
- Плотность
- Температура плавления
- Точка кипения
- Состав
- -Хлорид свинца (II)
- Молекула газовой фазы
- Свинец (IV) хлорид
- Номенклатура
- Приложения
- Хлорид свинца II
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Токсичность
- Acetyl
Видео:химическая реакция хлорида магния и нитрата свинца (ll)Скачать

Содержание:
В хлорид свинца представляет собой неорганическую соль, химическая формула которой PbClп, где n — степень окисления свинца. Итак, когда свинец +2 или +4, соль — это PbCl.2 или PbCl4соответственно. Таким образом, для этого металла существует два типа хлоридов.
Из двух PbCl2 это самое главное и стабильное; а PbCl4 это нестабильно и менее полезно. Первый имеет ионную природу, где катион Pb 2+ генерирует электростатические взаимодействия с анионом Cl – построить кристаллическую решетку; а второй — ковалентный, со связями Pb-Cl, образующими тетраэдр свинца и хлора.
Еще одно различие между двумя хлоридами свинца заключается в том, что PbCl2 Это твердое тело из белых кристаллов игольчатой формы (верхнее изображение); а PbCl4 Это масло желтоватого цвета, которое может кристаллизоваться при -15 ° C. Введите PbCl2 эстетичнее, чем PbCl4.
В дополнение к тому, что уже было упомянуто, PbCl2 в природе встречается как минерал котунит; а PbCl4 нет, так как он подвержен гниению. Хотя из PbCl4 вы можете получить PbO2, из PbCl2 они производят бесконечное множество металлоорганических соединений.
Видео:Электролиз. Получение хлора, получение свинца. Химия – ПростоСкачать

Свойства
Свойства хлорида свинца существенно зависят от степени окисления свинца; поскольку хлор не меняется, но меняется способ его взаимодействия со свинцом. Следовательно, оба соединения следует рассматривать отдельно; хлорид свинца (II), с одной стороны, и хлорид свинца (IV), с другой.
Видео:"Золотой дождь". Получение кристаллов йодида свинца (химия)Скачать

-Хлорид свинца (II)
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Молярная масса
Видео:Электролиз. 10 класс.Скачать

Внешность
Кристаллы белого цвета с игольчатой формой.
Видео:Реакция СВИНЦА и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Получение СУЛЬФАТА СВИНЦА.Простые опыты по химии.Скачать

Плотность
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Температура плавления
Видео:Синтез PbO2. Получение ДИОКСИДА СВИНЦА. Реакция ГИПОХЛОРИТА НАТРИЯ и НИТРАТА СВИНЦА. Опыты по химии.Скачать

Точка кипения
Видео:Нитрат свинца и "Буря в пробирке" (химия)Скачать

Растворимость воды
10,8 г / л при 20 ° С.Он плохо растворяется, и воду необходимо нагревать, чтобы можно было растворить значительное количество.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Показатель преломления
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Свинец (IV) хлорид
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Молярная масса
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Внешность
Желтоватая маслянистая жидкость.
Видео:NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Плотность
Видео:Свинец химические свойстваСкачать

Температура плавления
Видео:Реакция ДИОКСИДА СВИНЦА и ПЕРЕКИСИ ВОДОРОДА. Опыты по химии. Получение КИСЛОРОДА. ЭкспериментыСкачать

Точка кипения
50 ° С. При более высоких температурах он разлагается с выделением газообразного хлора:
Фактически, эта реакция может стать очень взрывной, поэтому PbCl сохраняется.4 в серной кислоте при -80 ° С.
Видео:Решение цепочек превращений по химииСкачать

Состав
Видео:Расчёт тепловых эффектов реакций по табличным даннымСкачать
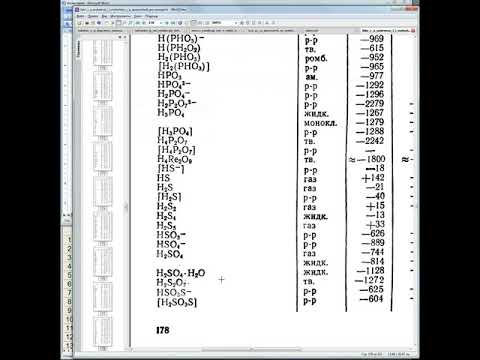
-Хлорид свинца (II)
Сначала упоминалось, что PbCl2 представляет собой ионное соединение, поэтому состоит из ионов Pb 2+ и Cl – строящие кристалл, в котором установлено соотношение Pb: Cl, равное 1: 2; то есть в два раза больше анионов Cl – какие катионы Pb 2+ .
В результате образуются орторомбические кристаллы, ионы которых можно представить в виде модели сфер и стержней, как на изображении ниже.
Эта структура также соответствует структуре минерала котунита. Хотя полосы используются для обозначения направленности ионной связи, ее не следует путать с ковалентной связью (или, по крайней мере, чисто ковалентной).
В этих орторомбических кристаллах Pb 2+ (сероватые сферы) имеет девять Cl – (зеленые сферы) окружают его, как если бы он был заключен в треугольную призму. Из-за сложности структуры и низкой ионной плотности Pb 2+ , молекулам трудно сольватировать кристалл; причина, по которой он плохо растворяется в холодной воде.
Видео:ПОЛУЧЕНИЕ ХЛОРИДА ЙОДА. Получение I2Cl6. Реакция Йода и ХлораСкачать

Молекула газовой фазы
Когда ни кристалл, ни жидкость не выдерживают высоких температур, ионы начинают испаряться в виде молекул PbCl.2 сдержанный; то есть с ковалентными связями Cl-Pb-Cl и углом 98 °, как если бы это был бумеранг. Тогда говорят, что газовая фаза состоит из этих молекул PbCl2 а не ионов, переносимых воздушными потоками.
Видео:Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]Скачать
![Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]](https://i.ytimg.com/vi/CRgMweu9_nE/0.jpg)
Свинец (IV) хлорид
Между тем, PbCl4 это ковалентное соединение. Зачем? Поскольку катион Pb 4+ меньше и также имеет более высокую плотность ионного заряда, чем Pb 2+ , что вызывает большую поляризацию электронного облака Cl – . В результате вместо взаимодействия ионного типа Pb 4+ Cl – , образуется ковалентная связь Pb-Cl.
Учитывая это, сходство между PbCl4 и, например, CCl4; оба встречаются как отдельные тетраэдрические молекулы. Таким образом, объясняется, почему этот хлорид свинца при нормальных условиях представляет собой желтоватое масло; Атомы Cl имеют слабое сродство друг к другу и «скользят», когда две молекулы PbCl4 они идут.
Однако, когда температура падает и молекулы замедляются, вероятность и эффекты мгновенных диполей (PbCl4 неполярен ввиду его симметрии); а затем масло застывает в виде желтых гексагональных кристаллов:
Обратите внимание, что каждая сероватая сфера окружена четырьмя зелеными сферами. Эти молекулы PbCl4 «Собранные вместе» составляют кристалл, который нестабилен и подвержен интенсивному разложению.
Номенклатура
Названия: хлорид свинца (II) и хлорид свинца (IV) соответствуют присвоенным согласно Товарной номенклатуре. Поскольку степень окисления +2 — самая низкая для свинца, а +4 — самая высокая, оба хлорида могут быть названы согласно традиционной номенклатуре как хлорид плюмбозы (PbCl2) и хлорид свинца (PbCl4) соответственно.
И, наконец, есть систематическая номенклатура, в которой указывается номер каждого атома в соединении. Таким образом, PbCl2 это дихлорид свинца, а PbCl4 тетрахлорид свинца.
Приложения
Практическое применение PbCl неизвестно.4 помимо того, что служит для синтеза PbO2. Однако PbCl2 Это более полезно, и поэтому ниже будут перечислены только некоторые применения этого конкретного хлорида свинца:
— Благодаря своей высокой люминесцентности он предназначен для использования в фотографических, акустических, оптических и радиационных детекторах.
— Поскольку он не поглощает в области инфракрасного спектра, он используется для изготовления очков, пропускающих этот тип излучения.
— Он был частью так называемого золотого стекла, привлекательного материала с переливающейся голубоватой окраской, используемого в декоративных целях.
— Также, в соответствии с предметом искусства, при подщелачивании PbCl2Свинец (ОН)2 приобретает интенсивные белесые тона, используется как белила. Однако его использование не рекомендуется из-за его высокой токсичности.
— Плавлен и смешан с титанатом бария, BaTiO.3, берет начало керамический титанат бария свинца Ba1 — хPbИксДядя3. Если Pb 2+ войти в БАТИО3, а Ba 2+ он должен покинуть кристалл, чтобы позволить его включению, и тогда говорят, что происходит катионный обмен; следовательно, состав Ba 2+ выражается как 1-x.
— И наконец, из PbCl2 синтезировано несколько металлоорганических соединений свинца общей формулы R4Pb или R3Pb-PbR3.
Хлорид свинца II
| Хлорид свинца II | |
|---|---|
| Систематическое наименование | Хлорид свинца |
| Традиционные названия | Хлористый свинец, дихлорид свинца |
| Хим. формула | PbCl2 |
| Рац. формула | PbCl2 |
| Состояние | прозрачные кристаллы |
| Молярная масса | 278,11 г/моль |
| Плотность | 5,85 г/см³ |
| Твёрдость | 2,5 |
| Температура | |
| • плавления | 498; 501 °C |
| • кипения | 950; 953; 954 °C |
| Мол. теплоёмк. | 77,0 Дж/(моль·К) |
| Энтальпия | |
| • образования | -360,0 кДж/моль |
| Растворимость | |
| • в воде | 0,978 20 ; 2,68 100 г/100 мл |
| Рег. номер CAS | 7758-95-4 |
| PubChem | 166945 |
| Рег. номер EINECS | 231-845-5 |
| SMILES | |
| RTECS | OF9450000 |
| ChEBI | 88212 |
| Номер ООН | 2291 |
| ChemSpider | 22867 |
| Токсичность | ядовит |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид свинца II — бинарное неорганическое соединение, соль металла свинца и соляной кислоты с формулой PbCl2, прозрачные кристаллы, слабо растворимые в воде.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Токсичность
Получение
- В природе встречается редкий минерал коттунит — PbCl2 с примесями, часто с небольшой радиоактивностью.
- Действие хлора на металлический свинец:
Pb + Cl2 → 200−300oC PbCl2
- Растворение в соляной кислоте оксида, гидроксида или карбоната свинца:
PbO + 2 HCl → PbCl2 ↓ + H2O Pb(OH)2 + 2 HCl → PbCl2 ↓ + 2 H2O PbCO3 + 2 HCl → PbCl2 ↓ + CO2 + H2O
Физические свойства
Хлорид свинца II образует прозрачные кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,7623 нм, b = 0,9048 нм, c = 0,4535 нм, Z = 4.
Диамагнитен, плохо растворяется в воде и этаноле на холоде. Токсичен, следует избегать попадания вещества внутрь орально либо ингаляционно. Это может привести к очень тяжёлым отравлениям.
Химические свойства
- В горячих водных растворах подвергается гидролизу до основной соли:
PbCl2 + H2O → 50oC Pb(OH)Cl + HCl
- Хорошо растворяется в концентрированной соляной кислоте:
PbCl2 + 2 HCl → H2[PbCl4]
- Разлагается щелочами:
PbCl2 + 2 NaOH → Pb(OH)2 ↓ + 2 NaCl PbCl2 + 4 NaOH → Na2[Pb(OH)4] + 2 NaCl
- Восстанавливается водородом:
PbCl2 + H2 → 300−350oC Pb + 2 HCl
- Вступает в обменные реакции:
PbCl2 + 2 KI → PbI2 ↓ + 2 KCl PbCl2 + H2S → PbS ↓ + 2 HCl
- В щелочной среде с карбонатами образует основную соль:
2 PbCl2 + Na2CO3 + 2 NaOH → Pb2(OH)2CO3 ↓ + 4 NaCl
Токсичность
Дихлорид свинца токсичен, как и все соединения свинца. Может привести к очень тяжёлым отравлениям свинцом.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. |

