| Хлорид серебра I | ||
|---|---|---|
| ||
| Систематическое наименование | Хлорид серебра I | |
| Традиционные названия | Хлорид серебра | |
| Хим. формула | AgCl | |
| Рац. формула | AgCl | |
| Состояние | твёрдое | |
| Молярная масса | 143,32 г/моль | |
| Плотность | 5,56 | |
| Твёрдость | 2,5 | |
| Температура | ||
| • плавления | 455 | |
| • кипения | 1554 °C | |
| Мол. теплоёмк. | 50,79 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −127 кДж/моль | |
| Удельная теплота испарения | 1,28⋅10 6 | |
| Удельная теплота плавления | 9,2⋅10 4 | |
| Давление пара | 1 Па , 10 Па , 100 Па , 1 кПа , 10 кПа и 100 кПа | |
| Растворимость | ||
| • в воде | 1,91⋅10 −5 г/100 мл | |
| • в этаноле | 1,5·10 −5 г/л | |
| • в метаноле | 6·10 −5 г/л | |
| • в ацетоне | 1,3·10 −5 г/л | |
| • в пиридине | 19,5 г/л | |
| Показатель преломления | 2,071 | |
| Дипольный момент | 6,08 ± 0,06 Д | |
| Рег. номер CAS | 7783-90-6 | |
| PubChem | 24561 | |
| Рег. номер EINECS | 232-033-3 | |
| SMILES | ||
| RTECS | VW3563000 | |
| ChEBI | 30341 | |
| ChemSpider | 22967 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
- Содержание
- Молекулярная и кристаллическая структура
- Физические свойства
- Получение
- Химические свойства
- Применение
- Безопасность
- Свойства хлорида серебра
- И целой страны мало
- Вещество одно, свойств много
- И для людей, и для науки
- Хлорид Серебра (свойства реакции применение FAQ)
- Что такое хлорид серебра (AgCl)
- Получение в лабораторных условиях
- Реакции хлорида серебра
- Минерал хлорид серебра
- Применение хлорида серебра
- Что мы узнали о хлориде серебра?
- Похожие страницы:
- Leave a Comment
- 📸 Видео
Видео:Серебро из хлорида серебраСкачать

Содержание
- 1 Молекулярная и кристаллическая структура
- 2 Физические свойства
- 3 Получение
- 4 Химические свойства
- 5 Применение
- 6 Безопасность
Видео:Получение хлорида серебра | Серебро из технического серебра контактов, автоматов и пускателейСкачать

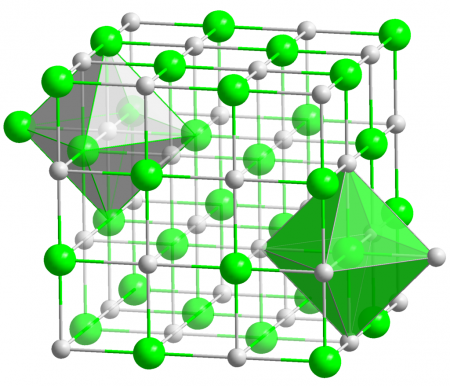
Молекулярная и кристаллическая структура
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Видео:Как получить хлорид серебраСкачать

Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Видео:Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Видео:Взаимодействие нитрата серебра и хлорида натрия. Химический опытСкачать

Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
AgCl + 2 NH3 ⋅ H2O = [Ag(NH3)2]Cl + 2 H2O AgCl + 2 Na2SO3S = Na3[Ag(SO3S)2] + NaCl AgCl + 2 KCN = K[Ag(CN)2] + KCl
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
AgCl + Cl − = [AgCl2] −
- Медленно реагирует с концентрированной серной кислотой при кипячении:
2 AgCl + H2SO4 = Ag2SO4 + 2 HCl ↑
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
2 AgCl + Ba(NO3)2 → NH 3 BaCl2 ↓ + 2 AgNO3
Видео:Качественная реакция на хлорид, бромид, йодид ион.Скачать

Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
Ag2S + 2 NaCl + 2 O2 → 600∘C 2 AgCl + Na2SO4
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Видео:Восстановление хлорида серебра алюминием и цинком Дешевый методСкачать

Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Видео:Получение нитрата серебра (химия)Скачать

Свойства хлорида серебра
Если подружить благородный металл серебро и соляную кислоту, получится хлорид серебра — бесцветные кристаллы или белая соль, способная плавиться при температуре 455° С и кипеть без разложения при 1554° С. Популярность пришла на заре развития фотографии. Способность изменять цвет завораживала. Но помимо светочувствительности, соединение хлора с серебром несет в себе много других замечательных свойств.
Видео:Получение НИТРАТА СЕРЕБРАСкачать

И целой страны мало
Серебро по латыни аргентум, поэтому обозначено в химии Ag. В честь него названа целая страна Аргентина, хотя рудники и добыча ведется по всему миру не одно тысячелетие. Есть стойкое убеждение, что запасов его гораздо меньше, чем золота, и придет время, когда их положение в иерархии драгоценностей поменяется. Время покажет, оправданы такие ожидания или нет.
А пока серебро широко используется не только ювелирами. Оно, как в чистом виде, так и в соединениях, широко используется в промышленности и в технике.
Формула хлорида серебра очень проста: одновалентный хлор соединяется с одновалентным Ag и на выходе получают вещество, которое записывается символом AgCl. Но в действительности процесс несколько сложнее. Хлор относится к группе галогенов, активных элементов 17-й группы периодической таблицы Д. И. Менделеева. Галоген с греческого «порождающий соль», потому что все галогены — активные окислители, в чистом виде в природе практически не встречаются.
Серебро, наоборот, принадлежит сообществу благородных металлов, включающему помимо него золото и платиновую группу. Все они, в той или иной степени, химически инертны, «неохотно» вступают в химические реакции. В природе существуют в соединениях и в чистом виде, таком как слитки, самородки, жилы и россыпи, за что их ценят ювелиры и монетные дворы.
Оно более активно, чем золото. Чтобы получить его хлорид, запускают взаимодействие растворимых серебросодержащих солей, обычно — нитрата серебра, с хлоридами, той же поваренной солью. В результате реакции замещения происходит выпадение осадка белого цвета. Соединение нестойкое, через некоторое время под воздействием света темнеет, потому что происходит выделение молекул чистого аргентума, которые соединяются с молекулами серы.
Сероводород всегда присутствует в атмосфере, вот почему серебряные вещи тускнеют и покрываются патиной. Соль, меняющая цвет, подтолкнула к идее фотографического изображения.
Видео:Как добыть чистое серебро?Скачать

Вещество одно, свойств много
У хлорида серебра кристаллическая структура кубического вида, где центральный атом образует с соседями октаэдр, почти такой же, как у поваренной соли NaCl (хлорид натрия). Но в отличие от последней, плохо растворим в воде. При 25° C произведение растворимости составляет всего 1,77•10−10. Показатели растворимости AgCl в минеральных маслах нулевые. Он не растворяется в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Зато растворим в водных растворах аммиака и в жидком аммиаке.
Модель молекулы аммиака
Аммиак — активное соединение водорода и азота, при его окислении образуются кислоты азота, которые легко увлекают металлы, создавая с ними соли, относящиеся к азотнокислым. В частности, нитрат серебра (формула AgNO3) — кристаллическое вещество, используемое для гальванического серебрения, в производстве зеркал, в медицине (ляпис) и для получения других соединений серебра, в том числе хлорида.
Светочувствительность AgCl, когда цвет меняется на глазах, быстро нашла применение в фотографии, но развитие химии показало, что бромид серебра обладает лучшими свойствами менять цвет под воздействием света.
Тем не менее, AgCl нашел себя в других областях человеческой деятельности. В первую очередь, в медицине и косметике, ведь антибактерицидные свойства серебра известны давно. Вода, в которую опустили серебряный крестик, не портится и не зацветает, становится святой.
Видео:Получение серебра - реакция серебряного зеркала! (химия)Скачать

И для людей, и для науки
Любое полезное свойство быстро находит применение. Препараты, в основе которых хлорид серебра, встречаются:
- среди мазей и гелей для борьбы с угревой сыпью у молодежи;
- в гомеопатии как материал с антибактериальными свойствами;
- в производстве лекарственных препараторов, в частности такого знаменитого, как Silargetten — главного средства борьбы с заражениями и сепсисом в эпоху до пенициллина.
В промышленности используется не менее широко:
- для компонентов фотоэмульсий и различных фотографических материалов;
- при изготовления электродов химических источников тока;
- для компонента электропроводящих стекол;
- в качестве материала для линз в ИК-спектроскопии;
- в виде промежуточного продукта при извлечении его из сульфидной руды;
- в качестве реагента для сереброорганических соединений.
AgCl большей частью производится лабораторным способом, но его можно встретить и в природе в виде минерала хлораргирита.
При работе всегда есть опасность раздражения на коже и на слизистых оболочках с последующими осложнениями.
Видео:ПОЛУЧЕНИЕ СЕРЕБРА. Выпадение Серебра С Помощью Окислительно-Восстановительной РеакцииСкачать

Хлорид Серебра (свойства реакции применение FAQ)
Хлорид серебра это химическое вещество состоящее из серебра и хлора, сложное вещество, в природе встречается в виде минералов хлораргирит (chlorargyrit) фото, синоним — роговая серебряная обманка.
Основное применение хлорида серебра в производстве некоторых органических веществ, лекарственных препаратов, светочувствительных компонентов и т.д.
Видео:Периодат Серебра - Ag3IO5. Реакция Дигидроортопериодата Натрия - Na3H2IO6 и Нитрата Серебра - AgNO3.Скачать

Что такое хлорид серебра (AgCl)
Это белый порошок который на свету темнеет становясь серым , при нагревании плавится становясь жёлто — коричневым , при дальнейшем нагревании кипит без разложения.
Не растворим в воде и не образует кристаллогидратов. С концентрированными гидратом аммиака , образуя комплексное соединение.

Температура кипения — 1554°C
Состояние — Твёрдое
Молярная масса — 143,32г/моль
Плотность -5,56
Твёрдость -2,5
Видео:Серебро в ОСАДКЕ. Творожок ХЛОРИДА СЕРЕБРА 🥰 #химия #experiment #chem #chemolife #amazing #сереброСкачать

Получение в лабораторных условиях
Реакцией всех растворимых солей серебра с соляной кислотой :
Реакцией растворимых солей с солями хлоридов :
Нагреванием сульфида серебра с хлоридом натрия в кислороде при нагревании 600°C :
Видео:Восстановление хлорида серебра до 999 металла. Convert silver chloride to 999 metal.Скачать

Реакции хлорида серебра
Хлорид серебра обладает слабыми свойствами фотолиза и медленно разлагается на свету на простые вещества серебро и хлор :
При температуре выше 450°C в присутствии щелочей разлагается получением простого вещества серебра , хлорида щелочного металла и кислорода :
4AgCl + 4КОН = 4КСl + 4Ag + O2 + 2Н2O
Нагревание до температуры свыше 850°C приводит к получению свободного вещества серебра , хлорида натрия , углекислого газа и кислорода :

4AgCl + 2BaO = 2BaCl2 + 4Ag + O2
Реакция с перекисью водорода , гидроксида калия ( разб . ) даёт свободное вещество серебро , хлорид калия и кислород :
С сульфидом натрия натрия при нагревании , получается сульфид серебра и хлорид натрия :
Фтор будучи более сильным галогеном чем хлор вытесняет его , образуя фторид серебра и хлор :

Соединение аммиакат серебра с ацетиленом дает стабильный ацетиленид серебра, который считается инициирующим взрывчатым веществом и работа с ним очень опасна так как ацетиленид легко детонирует от трения, удара и нагрева:
Единственный способ утилизации его реакция с серной кислотой.
Подобно ( нашатырному спирту ) реагирует с карбонатом аммония образуя комплексного соединения и углекислого газа :
Реакция с тиосульфатом натрия ( конц .) даёт комплексное соединение бис(тиосульфато)аргентат(I) и хлорид натрия :
Хлорид серебра реагирует солями цианидов ( конц .) образуя комплексные соединения и хлорид калия :
AgCl + 2KCN = K[Ag(CN)2] + KCl
Реакция с (тиоцианидом, роданидом, сульфоцианидом) калия даёт сложное комплексное соединение при комнатной температуре и хлорид калия :
Видео:Реакция ХЛОРИДА ОЛОВА и ДИХРОМАТА АММОНИЯ в кислой среде. Получение ХЛОРИДА ХРОМА. Опыты по химииСкачать

Минерал хлорид серебра
Это минерал хлораргирит химический состав: Ag — 75,3%, Сl — 24,7%. В качестве примесей иногда присутствует Hg (Br, Cl).
В свежих образцах бесцветный, прибывание на свету окрашивает его вначале фиолетово-серый, а потом даже черный цвет.
Образуется в зоне окисления серебросодержащих месторождений, где ассоциирует с минералами серебра, меди, кальцитом, баритом и др.
Используется как руда в получении серебра и иногда как сопутствующие с ним вещества ртуть и бром.
Видео:нитрат серебра с хлоридом аммонияСкачать

Применение хлорида серебра
- В фотографической промышленности для получения светочувствительных компонентов.
- В производстве некоторых косметических средств на основе ионов серебра , борющихся с проблемной кожей в основном у молодёжи.
- Хлорид серебра используется в производстве лекарственных препараторов .
- В гомеопатии используется как материал с антибактериальными свойствами .
- Использование в производстве материала для линз в ИК — спектроскопии .
- Как промежуточный продукт в производстве серебра из руд содержащих сульфид серебра Ag2S .
- Применяется в производстве серебро органических соединений, например ацетиленид серебра и т.д.
Видео:АФФИНАЖ СЕРЕБРА НОВЫМ МЕТОДОМ! Минуя ХЛОРИД СЕРЕБРА.. АЛЮМИНИЙ, МЕДЬ и ПРОЧЕЕ..!Скачать

Что мы узнали о хлориде серебра?
- Что такое хлорид серебра
Это химическое соединение в состав которого входит серебро и хлор.
Какого цвета осадок хлорида серебра
Хлорид серебра (I) в расплавленном виде, имеет желто–коричневый цвет. Расплав хлорида серебра (I) после остывания, образует полупрозрачную массу, которая в обиходной речи, иногда называется как — «роговое серебро».
Как из AgCl получить серебро
Для этого нужно прореагировать его с перекисью водорода в присутствии гидроксида калия.
Есть минерал в состав которого входит хлорид серебра
Это минерал называется хлораргирит, в его химическую формулу могут входить и другие химические элементы такие как ртуть и бром
Статья на тему хлорид серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
📸 Видео
Монооксид Серебра - Ag2O2. Реакция Оксида Серебра, Перманганата Калия и Гидроксида Натрия.Скачать

разные способы восстановления после хлорида серебраСкачать