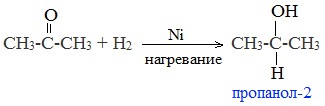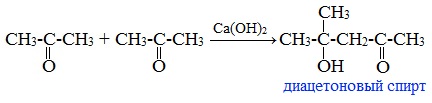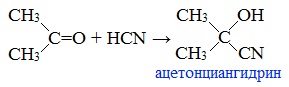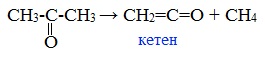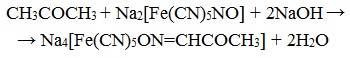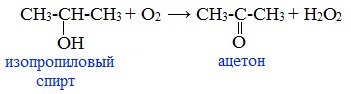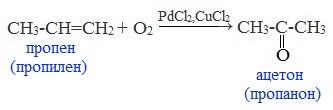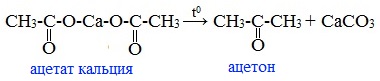- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Пропанол-2: химические свойства и получение
- Строение пропанола-2
- Водородные связи и физические свойства спиртов
- Изомерия пропанола-2
- Структурная изомерия
- Химические свойства пропанола-2
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление спиртов
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование пропанола-2
- Получение пропанола-1
- 1. Щелочной гидролиз галогеналканов
- 2. Гидрирование карбонильных соединений
- 3. Гидратация алкенов
- Уравнение реакции получения ацетона из пропанола 2
- Физические свойства
- Токсичность ацетона
- Химические свойства
- Получение
- Применение
- 📹 Видео
Видео:Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

We are checking your browser. gomolog.ru
Видео:ПОЛУЧЕНИЕ ХЛОРОФОРМА. Реакция Гипохлорита Натрия и Ацетона. Реакция NaClO + (CH3)2COСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Получение ацетона из ацетата кальция | Getting acetone from calcium acetateСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de413603f737b2b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Получение АЦЕТОНАСкачать

Пропанол-2: химические свойства и получение
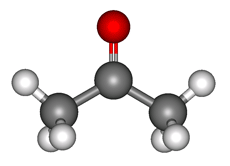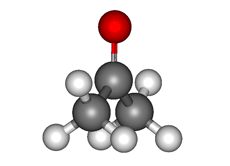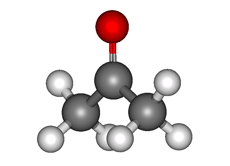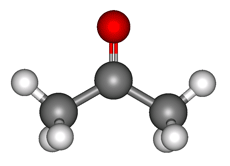
Пропанол-2, изопропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Задание №32 в ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Строение пропанола-2
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому пропанол-2 очень хорошо растворим в воде. Молекулы пропанола-2 в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол-2 смешивается с водой в любых соотношениях.
Видео:Получение ХЛОРОФОРМА (загрязненного). Реакция ГИПОХЛОРИТА НАТРИЯ и АЦЕТОНА. Опыты по химииСкачать

Изомерия пропанола-2
Видео:Получение АЦЕТОНА!Скачать

Структурная изомерия
Для пропанола-2 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Видео:Все задания №32 из сборника ЕГЭ 2023 (часть 2) | Химия ЕГЭ для 10 класса | УмскулСкачать

Химические свойства пропанола-2
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-2
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-2 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-2 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-2 взаимодействует с калием с образованием изопропилата калия и водорода . |
2СН3–CH OH –CH3 + 2K → 2СН3–CHOK –CH 3 + H 2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, изопропилат калия разлагается водой: |
СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
Видео:Ацетат кальция и ацетонСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-2 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии пропанола-2 с аммиаком образуется изопропиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, изопропанол реагирует с уксусной кислотой с образованием изопропилацетата (изопропилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии пропанола-2 с азотной кислотой образуется изопропилнитрат. |
Видео:Составление уравнений реакций для генетических цепочек по кислородсодержащим. часть 1Скачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-2 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-2 при низкой температуре образуется диизопропиловый эфир: |
Видео:Синтез АЦЕТОНА из ИЗОПРОПИЛОВОГО спирта. Качественная реакция на АЦЕТОНСкачать
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Вторичные спирты окисляются до кетонов.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
| Например, при окислении пропанола-2 образуется ацетон |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) вторичные спирты также окисляются до кетонов.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания пропанола-2: |
Видео:Получение (синтез) ацетона (synthesis of acetone) CH3COCH3Скачать

5. Дегидрирование пропанола-2
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании пропанола-2 образуется ацетон. |
Видео:Лабораторный синтез ацетонаСкачать

Получение пропанола-1
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 2-хлорпропана с водным раствором гидроксида натрия образуется пропанол-2 |
СН3–CHCl –CH 3 + NaOH → СН3–CHOH–CH3 + NaCl
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании кетонов образуются вторичные спирты.
| Например: при гидрировании ацетона образуется изопропанол |
Видео:ВПР по химии 11 класс Видеоурок 15/15 ЗАДАНИЕ 14 Органическая химия Взаимосвязь Цепочка 10 классСкачать

3. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Видео:Способы получения предельных одноатомных спиртовСкачать

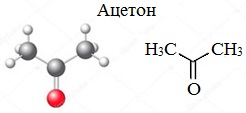
Уравнение реакции получения ацетона из пропанола 2
Ацетон — простейший представитель насыщенных кетонов.
Физические свойства
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 56 0 С.

Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.
Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
1. Гидрирование (восстановление)
При тех же условиях, что и формальдегид, ацетон присоединят водород:
Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
2. Взаимодействие с гидросульфитом натрия
Ацетон один из немногих кетонов образует бисульфитное соединение:
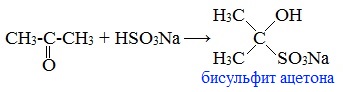
Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:
4. Взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
5. Пиролиз ацетона
При нагревании выше 500 0 C ацетон распадается на кетен и метан:
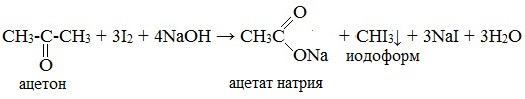
6. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на ацетон!
При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:
Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
7. Взаимодействие с нитропруссидом натрия
Качественная реакция на ацетон!
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску . При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую :
Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
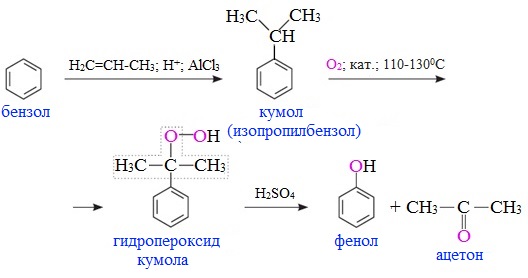
1.Кумольный способ
Данный способ получения фенола основан на окислении кумола (изопропилбензола). В качестве исходных продуктов используют бензол и пропилен.
Процесс протекает в три стадии. На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
Окисление кумола — экономически выгодный метод, так как позволяет получить наряду с фенолом другой важный продукт — ацетон (на 1 кг фенола приходится 0,6 кг ацетона). В настоящее время этот метод наиболее широко используется в промышленности и позволяет производить более 80% синтетического фенола.
2. Окисление изопропилового спирта
Ацетон получают в больших количествах при окислении изопропилового спирта:
В качестве катализатора применяется медь, серебро, никель, платина и др. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-650 0 С.
Если процесс окисления протекает в жидкой фазе, то, как побочный продукт образуется пероксид водорода:
3. Каталитическое окисление пропена кислородом воздуха
В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2 и CuCl2 при температуре 100 0 C:
4. Брожение крахмала
Незначительное значение имеет метод брожения крахмала под действием бактерий с образованием ацетона и бутанола. Метод характеризуется малыми выходами.
5. Пиролиз ацетата кальция
Ацетон можно получить пиролизом ацетата кальция:
6. Гидратация ацетилена водяным паром
Реакция протекает при 400-460 0 С над катализатором, содержащим оксиды железа и марганца:
Применение
В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ, а также в фотографии.
Ацетон применяется в производство искусственного шелка и синтетической кожи, в производстве смазочных масел, бездымного пороха, кинопленки.
В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ, витамин С.
Метилметакрилат применяется, главным образом, в виде листов пластика, порошков для литья и формовки, поверхностных покрытий, эмульсионных полимеров, волокон, чернил и пленок.
Метилметакрилат также применяется в производстве материалов, известных под названием плексигласа или люцита. Они используются в зубных протезах, твердых контактных линзах, и клеях.
Метилметакрилат – мономер для синтеза полиметилметакрилата («органическое сырье»).
📹 Видео
7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Решаем два варианта Добротина за 2 часаСкачать

Химические свойства альдегидов и кетонов. 11 класс.Скачать