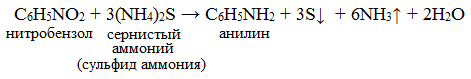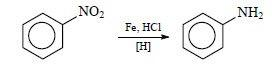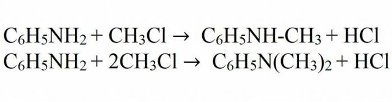Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком О. Унфердорбеном и назвал его «кристалликом».
В 1834 году Ф. Ф. Pyнгe обнаружил анилин в каменноугольной смоле и назвал его «кианолом».
В 1841 году Ю.Ф. Фрицше получил анилин нагреванием индиго с раствором едкого кали KOH и назвал его «анилином».
В 1842 году Н.Н. Зинин получил анилин восстановлением нитробензола сульфидом аммония и назвал его «бензидамом».
В 1843 году А. В. Гофман установил идентичность всех перечисленных соединений.
Восстановление нитросоединений (реакция Зинина)
Основной способ получения анилина – восстановление нитробензола.
Анилин и другие первичные ароматические амины получают с помощью рtакции, открытой русским химиком Н.Н. Зининым. В качестве восстановителя Н.Н. Зинин применял сульфид аммония:
Впоследствии в качестве восстановителя стали применять водород.
Промышленный способ
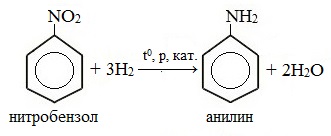
1. Каталитическое восстановление нитробензола (восстановление нитробензола молекулярным водородом)
В настоящее время этот способ восстановления нитробензола с целью получения анилина в промышленности является основным.
Смесь паров нитробензола и водорода пропускают над катализатором при температуре 300 0 С и повышенном давлении:
Лабораторный способ
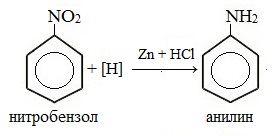
1. Восстановление нитробензола атомарным водородом
В лаборатории для этой цели используют цинк в кислой среде:
Восстановителем в этой реакции является атомарный водород, который получается в момент его выделения.
Видео:12. В-О Получение анилинаСкачать

Анилин — структурная формула и свойства органического соединения
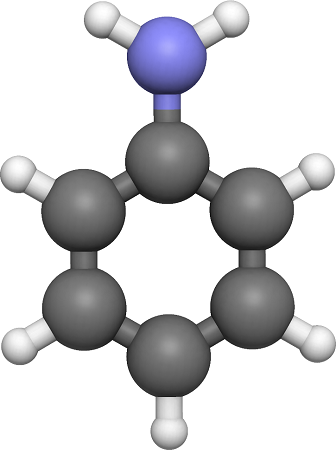
Анилин – это соединение, которое относят к органическим веществам. Принадлежит к классу аминов. Чтобы понять, что такое амины, можно представить формулу аммиака, затем один атом водорода или все заменить углеводородным радикалом.
Видео:Реакция Зинина #shortsvideoСкачать

Анилин (фениламин) — понятие, строение, физические свойства
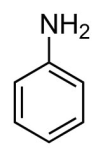
Если в формуле аммиака только один водородный атом заменить фенил радикалом, получится анилин (фениламин). Поэтому его можно считать производным аммиака. Вещество называют также аминобензол.
Можно иначе представить это соединение. Если в формуле бензола вместо одного водорода поставить аминогруппу, получается анилин. Значит это производная бензола, где атом водорода замещается на аминогруппу.
Эмпирическая (молекулярная) формула фениламина C6H5 NH2. Его записывают с помощью структурной формулы:
Аминобензол содержит две группы атомов: аминогруппу и фенил радикал. Они оказывают влияние на свойства вещества.
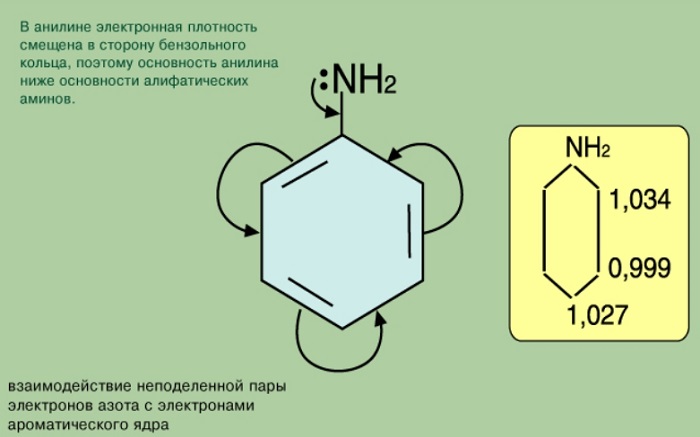
Аминогруппа NH2– состоит из атома азота и двух атомов водорода. У азота на внешнем энергетическом уровне содержится 5 электронов. Два электрона образуют химическую связь с атомами углерода, один электрон образует связь с углеродом фенил радикала. У него еще остаётся два электрона. Они образуют свободную пару электронов.
Аминогруппа в составе анилина может присоединять протон водорода. Поэтому соединение проявляет свойства оснований. Так как по определению, вещества, присоединяющие протон водорода, принято считать основаниями.
Фенил радикал C6H5 – имеет в своём составе бензольное кольцо. Благодаря этому фениламин должен вступать в реакции, характерные для бензола.
Так как 2 группы атомов находятся в одном соединении, они оказывают влияние друг на друга.
Фенил радикал, влияя на функциональную группу, вовлекает свободную пару электронов в π — электронную систему. Такое смещение плотности влияет на проявление свойств соединения как основания. В результате фениламин не вступает во взаимодействие с водой. Аммиак, таким образом, более сильное основание.
Функциональная группа влияет на π — систему. Нарушается равномерное распределение электронной плотности. Она повышается у атомов 2,4,6 (в орто — и пара — положениях). Именно здесь будет идти замена водорода на другие атомы в химических реакциях.
Фениламин — это жидкость, маслянистая и ограниченно растворяющаяся в воде. Растворяется в органических соединениях.
Кипит при температуре 184 0 С, замерзает при температуре –6 0 С. При окислении окрашивается в красно-бурый цвет. Молярная масса 93 г/моль. Плотность вещества при 20 0 С составляет 1,02173 г/см 3 .
Вещество ядовито. Его относят ко второму классу опасности. При контакте с кожей может вызвать аллергию. При попадании в организм вызывает отравление. Есть информация о том, что оно может вызвать генетические мутации, возникает риск возникновения раковых заболеваний. Его называют ядом крови, так как вызывает кислородное голодание.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Получение анилина
Фениламин получают из нитробензола. Данный способ был предложен русским учёным Н. Н. Зининым. Поэтому получил название «реакция Зинина».
Проводят взаимодействие железа с нитробензолом в присутствии соляной кислоты.
Идёт восстановление нитробензола до анилина. Синтез можно представить уравнениями реакций:
Fe + 2HCl = FeCl2 + 2H
При взаимодействии анилина с галогеналканами и спиртами получают смесь вторичных, а также третичных аминов. Такое превращение носит название алкилирование.
Видео:Габриелян химия 11 кл решение задачи 8 стр 192Скачать

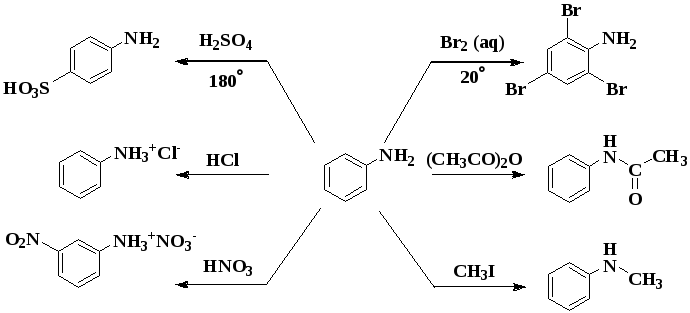
Химические свойства анилина
Для вещества характерны две группы свойств.
Реакции, идущие за счет функциональной группы.
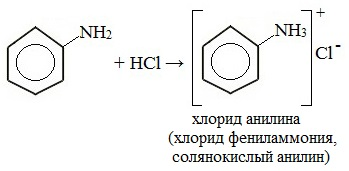
Фениламин взаимодействует с кислотами. В результате образуются соли. При взаимодействии анилина с хлороводородной кислотой получается хлорид фениламмония, или анилин солянокислый:
Свойства, идущие за счёт фенил радикала.
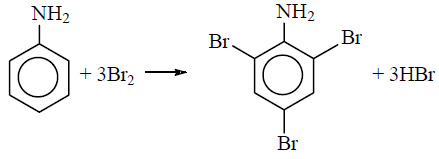
Для фениламина характерна реакция замещения, например бромирование. В результате получают 2,4,6 триброманилин. Образуется осадок белого цвета, поэтому реакцию считают качественной на обнаружение данного вещества.
Уравнение реакции с бромом выглядит следующим образом:
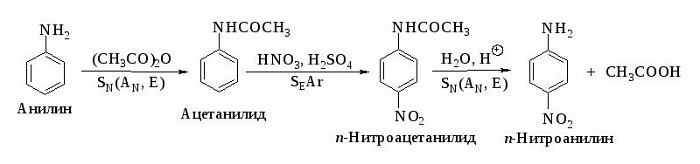
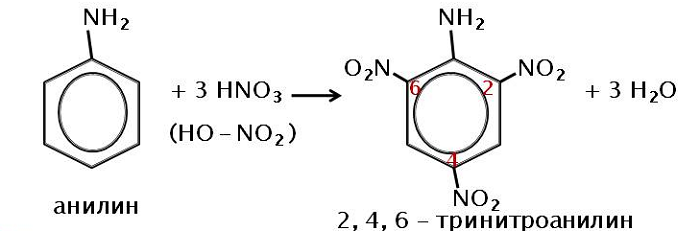
Нитрование, при котором происходит замещение в кольце ароматических аминов:
Вступает во взаимодействие с азотной кислотой, образуя тринитроанилин.
Видео:12.4. Анилин: Строение, химические свойства, способы получения. ЕГЭ по химииСкачать

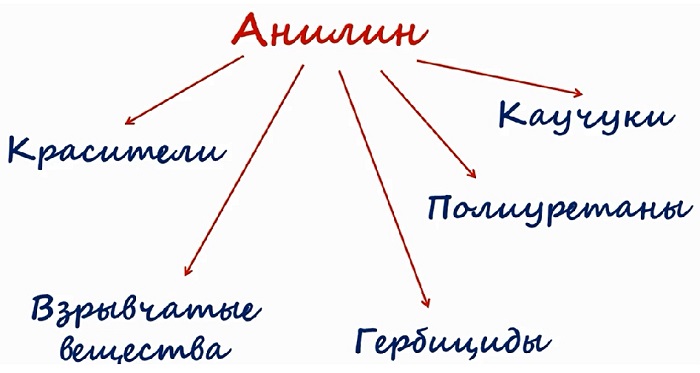
Применение анилина
Большая часть фениламина идёт для синтеза красителей. Его используют в получении типографской краски и синтетических красителей для текстильной промышленности.
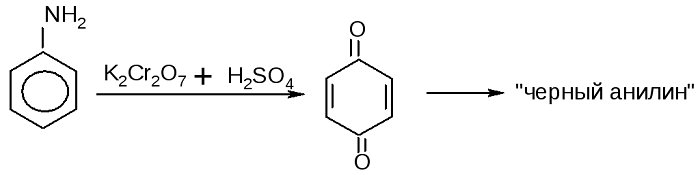
Так в кислой среде анилин окисляется дихроматом калия, в результате получается чёрный краситель. Эта реакция также рассматривается как качественная на фениламин:
Вещество является исходным для получения лекарственных препаратов. Сульфаниламидные соединения, получаемые на основе анилина, используют в медицине в качестве лекарств. Это производные анилина. К ним относятся: парацетамол, фенацетин и другие.
Также на основе соединения производят химические средства защиты растений, различные смолы, крем для обуви, взрывчатые вещества.
Видео:4.2. Алкадиены (диены): Способы получения. ЕГЭ по химииСкачать

АНИЛИН ЗИНИНА
Как уже говорилось, при коксовании угля образуется значительное количество каменноугольного дёгтя. Этот продукт явился исходным сырьём для получения разнообразнейших синтетических веществ. Каменноугольный дёготь дёшев и прост в обработке.
Правда, развитие органического синтеза, появление новых методов обработки сырья «некаменноугольного происхождения» (нефти, дерева и т. п.) постепенно отодвинули каменноугольный дёготь по количеству получаемой из него продукции на второе место. Тем не менее каменноугольный дёготь остаётся важнейшей базой органического синтеза и по сей день.
В каменноугольном дёгте есть бензол, толуол, нафталин, антрацен и другие ценные вещества. Одним из самых важных промышленных веществ является бензол.
Уже давно было известно, что при обработке бензола смесью серной и азотной кислот образуется светложёлтая жидкость с миндальным запахом — нитробензол.
В 1842 году знаменитый русский химик Николай Николаевич Зинин, исследуя нитробензол, нашёл способ превращения его в анилин — основу для производства различных красок. Анилин раньше получался путём переработки дорогой природной краски индиго.
Зинин понял всё огромное значение открытой им реакции и провёл широкие исследования со многими другими веществами.
Через 15 лет способ Зинина был внедрён в производство и стал фундаментом анилино-красочной промышленности во всём мире. Если прибавить к этому, что от анили- но-красочной промышленности очень скоро отделились фармацевтическая промышленность, промышленность взрывчатых веществ и промышленность душистых веществ и что во всех этих производствах реакция Зинина
Николай Николаевич Зинин (1812—1880).
Занимает одно из центральных мест, то огромное значение открытия Зинина становится ещё более очевидным.
Зинин был крупнейшим химиком своего времени. Вспоминая о Зинине, его ученик А. М. Бутлеров писал: «С его научной и педагогической деятельностью соединено возникновение русской химической школы; ему обязана русская химия по преимуществу своим вступлением в самостоятельную жизнь; его труды впервые заставили учёных Западной Европы отвести русской химии почётное место. Громкое имя Зинина открывает собою целый ря! имён русских химиков, сделавшихся известными в науке, и большая часть этих химиков — ученики Зинина или ученики его учеников.
Именем Зйнина может по справедливости гордиться русская наука».
Николай Дмитриевич Зелинский (1860—1953).
Один из основателей и научный руководитель немецкой анилино-красочной промышленности Гофман, охарактеризовав значение работ Зинина на заседании немецкого химического общества в марте 1880 года по случаю смерти Зинина, закончил свою речь следующими словами:
«Если бы Зинин не сделал ничего более, кроме превращения нитробензола в анилин, то и тогда его имя осталось бы записанным золотыми буквами в истории химии».
Существует много других отраслей химической промышленности, где бензол является важным исходным продуктом. Он необходим при производстве различных пластических масс, искусственного волокна и т. д. В последние годы наметилась новая область применения бензола. Дело в том, что бензол оказался значительно лучшим горючим для скоростных самолётов, чем бенэин.
В настоящее время того количества бензола, которое получается из каменного угля, становится уже недостаточно. Встаёт вопрос о получении бензола искусственным путём. И такие пути уже имеются. Их открыл крупнейший советский химик-органик Николай Дмитриевич Зелинский. По одному из этих методов, для получения бензола нужны ацетилен и активированный уголь, тот самый активированный уголь, который Н. Д. Зелинский использовал для защиты людей от отравляющих веществ в мировую войну 1914—1918 годов, создав первый в мире угольный противогаз.
Если ацетилен пропускать над нагретым активированным углём, то три молекулы ацетилена, соединяясь друг с другом, дают молекулу бензола. Этому простому способу получения бензола несомненно принадлежит большое будущее.
Нафталин, антрацен, толуол и другие продукты, получаемые из каменного угля, идут для приготовления разнообразных химических продуктов. Об этом мы расскажем дальше.
📽️ Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакция ЗининаСкачать

Амины. Получение. Все 11 реакций ЕГЭ.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать

Самый легкий способ уравнять ОВР в органике!Скачать

25. Схема реакции и химическое уравнениеСкачать

Амины. АнилинСкачать

Именные реакции в органической химии | Химия ЕГЭСкачать

8.2. Многоатомные спирты (этиленгликоль, глицерин): Способы получения. ЕГЭ по химииСкачать

Реакция ВюрцаСкачать