Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Please wait.
Видео:Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70093b301de54c98 • Your IP : 178.45.155.83 • Performance & security by Cloudflare
Видео:получение аммиакаСкачать

Синтез аммиака из смеси азота и водорода
Равновесие реакции синтеза аммиака из простых веществ:
смещается вправо с понижением температуры и повышением давления. Содержание аммиака в равновесной газовой смеси приведено в таблице 1.7.
Реакция между азотом и водородом может протекать только на катализаторе, который работает в интервале температур 450-520 о С.
В этих условиях при однократном проходе азотоводородной смеси через слой катализатора только часть ее превращается в аммиак (см. таблицу 1.7).
Таблица 1.7 — Содержание аммиака в равновесной газовой смеси (по данным А.Т. Ларсона и Р.Л. Доджа)
| Температура, К | Содержание NH3 (% об.) при давлении, МПа | |||
| 10,4 5,3 3,9 2,8 2,0 1,6 1,2 0,5 0,2 | — 30,9 24,9 20,2 13,4 13,0 10,4 4,5 2,2 | — — — — 35,5 31,0 26,2 12,9 7,3 | — — — — 53,6 47,5 42,1 24,0 12,6 | — — — — 69,4 63,5 — 31,4 12,9 |
Степень превращения азота и водорода зависит от условий процесса и обычно колеблется в пределах 15-30 %. Для увеличения степени использования азотоводородной смеси в условиях промышленного синтеза аммиака применяется многократная циркуляция газа через катализатор с промежуточным выделением аммиака – так называемый круговой аммиачный цикл.
Практически синтез аммиака проводится под давлением 10-90 МПа и при температуре 670-770 К.
В азотоводородной смеси всегда содержатся так называемые инертные примеси (метан и аргон), не принимающие участия в реакции. Их содержание в свежей азотоводородной смеси определяется методом ее получения.
Поскольку находящиеся в азотоводородной смеси инертные примеси понижают парциальное давление реагирующих газов, то содержание аммиака в равновесной смеси понижается, при этом в большей степени, чем соответствовало бы снижению парциальных давлений азота и водорода. Равновесная концентрация аммиака в присутствии инертных примесей определяется:

где Z0 – концентрация аммиака в равновесной смеси без инертных примесей;
i – содержание инертных примесей в долях единицы.
Только небольшое количество инертных примесей растворяется в жидком аммиаке и выводится из цикла, основное количество инертных примесей накапливается в цикле. Значительное содержание инертных примесей в циркуляционном газе приводит к уменьшению парциальных давлений азота и водорода и к снижению производительности катализатора.
Для поддержания нормальных условий процесса необходим непрерывный отвод из цикла некоторого количества циркулирующего газа. Выводимые газы называются продувочными, а процесс – продувкой. Место продувки определяется технико-экономическими расчетами и чаще всего находится в цикле на линии наибольшего содержания инертных примесей в циркуляционном газе.
1.10.1 Катализаторы процесса синтеза аммиака
Синтез аммиака из газообразных азота и водорода протекает с измеримой скоростью только при участии твердых катализаторов. Катализаторами, ускоряющими процесс образования аммиака, являются железо, осмий, уран, молибден, марганец, вольфрам и некоторые другие металлы.
К промышленным катализаторам синтеза аммиака предъявляются высокие требования. Катализатор должен быть активным в течение длительного времени, стойким к действию катализаторных ядов — примесей, которые могут поступать в колонну синтеза аммиака с азотоводородной смесью. Поэтому в процессе синтеза аммиака необходимо использовать азотоводородную смесь высокой чистоты, что особенно важно в связи со строительством и внедрением в промышленность мощных агрегатов синтеза аммиака.
Для изыскания активных катализаторов синтеза аммиака были проведены многочисленные исследования, в результате которых установлено, что катализаторы, состоящие из нескольких веществ, более активны, чем отдельные составляющие их вещества. Особенно активными и более дешевыми являются железные катализаторы, активированные некоторыми металлами. Очень высокой активностью обладает пористое железо, полученное восстановлением магнитного смешанного оксида железа Fe3О4 при температуре 570-670 К.
При температурах синтеза аммиака происходит рост кристаллов железа, вследствие чего уменьшаются количество неуравновешенных атомов и поверхность катализатора, что приводит к снижению его активности. Чтобы при длительной работе катализатора воспрепятствовать переходу его активных центров в неактивное состояние, в состав катализатора вводят активаторы (промоторы), например оксид алюминия, который трудно восстанавливается и обволакивает образовавшиеся кристаллы железа тонкой оксидной пленкой, затрудняющей взаимодействие между атомами железа и поэтому замедляющей рост кристаллов.
При отсутствии в катализаторе оксида алюминия А12О3 кристаллы железа в процессе синтеза аммиака укрупняются и удельная поверхность катализатора сокращается. При наличии же оксида алюминия приостанавливается рост кристаллов по отдельным граням, размеры кристаллов сохраняются. Таким образом, оксид алюминия препятствует спеканию кристаллов железа друг с другом, вследствие чего их удельная поверхность сохраняется на уровне 15 м 2 /г. Оптимальное количество А12О3 в сплаве с Fe3О4 составляет 2-4 %. Дальнейшее увеличение содержания А12О3 в сплаве нецелесообразно, поскольку оксид алюминия не участвует во взаимодействии Н2 и N2 (как железо), но может задерживать на поверхности катализатора уже образовавшийся аммиак.
Поэтому кроме А12О3 в железный катализатор вводят оксид калия К2О. Его активирующее действие обусловлено тем, что он способствует удалению с поверхности катализатора образовавшегося аммиака в газовый объем. Количество вводимого в катализатор оксида калия должно быть пропорционально добавке А12О3. Установлено, что соотношение А12О3 : К2О должно составлять
2 в дважды промотированных катализаторах. В катализаторах более сложного состава соотношение А12О3 : (СаО + К2О) должно быть равно 1.
В результате всестороннего изучения влияния других добавок на активность катализатора оказалось, что введение диоксида коемния в состав катализатора понижает его активность. При одновременном же добавлении оксидов коемния, кальция (или магния) активность катализатора возрастает.
Механизм реакции синтеза аммиака на катализаторе по Франкенбургеру можно представить следующим образом. Адсорбированные молекулы азота реагируют с атомами железа, образуя нитриды FeN. Молекулы водорода, взаимодействуя на поверхности катализатора с нитридами железа, образуют ряд промежуточных комплексных соединений FexNH, FexNH2, вплоть до FexNH3. Комплекс FexNH3 является нейтральным и его разложение приводит к образованию аммиака NH3, молекулы которого десорбируются с поверхности катализатора в газовый объем.
К настоящему времени широко известна теория электронного механизма катализа, протекающего по окислительно-восстановительному типу. Согласно этой теории, в процессе синтеза аммиака водород, являющийся донором электронов, передает их металлу катализатора и содержащимся в нем полупроводникам (некоторые промотирующие оксиды). Азот в данном случае является акцептором электронов и, воспринимая их от катализатора, приобретает повышенную активность. В дальнейшем происходит образование аммиака.
1.10.2 Выбор оптимальных условий процесса синтеза аммиака
Из теоретических основ процесса синтеза аммиака следует, что температура является важнейшим фактором, определяющим равновесное состояние системы и скорость реакции. Ранее было показано, что равновесный выход аммиака увеличивается с понижением температуры. Вместе с тем скорость реакции и активность катализаторов возрастают с повышением температуры. Следовательно, при выборе оптимальной температуры необходимо учитывать взаимное влияние двух конкурирующих факторов — состояния равновесия и скорости реакции синтеза аммиака.
Кроме того, выбор температуры для синтеза аммиака тесно связан с выбором катализатора. До настоящего времени нет катализаторов, эффективно ускоряющих процесс при температурах ниже 400 °С.
Для катализаторов, применяемых в промышленности синтеза аммиака, оптимальной областью температур являются температуры 475-500 °С. Это видно из данных, приведенных в таблице 1.8 и показывающих содержание аммиака на выходе из зоны катализа в зависимости от температуры при различных объемных скоростях газа (последняя представляет собой отношение объема пропускаемого через катализатор газа – по условиям входа или выхода из катализатора – к объему катализатора).
Таблица 1.8 — Содержание аммиака в газовой смеси, % об.
| Объемная скорость газа, ч —1 | Температура, °С | ||||||||
| Давление, МПа | |||||||||
| 14,5 | 29,8 | 19,6 | 32,7 | 21,6 | 34,8 | 23,0 | 34,0 | 19,3 | 31,8 |
| 11,7 | 25,7 | 14,6 | 28,3 | 17,7 | 30,11 | 8,22 | 8,2 | 16,7 | 27,8 |
| 9,4 | 23,1 | 12,7 | 24,4 | 15,2 | 24,2 | 16,5 | 27,2 | 15,7 | 25,9 |
| 8,0 | 21,2 | 11,2 | — | 13,3 | — | 14,6 | — | 14,6 | — |
| 6,9 | — | 10,2 | 19,3 | 10,5 | 21,9 | 11,4 | 12,3 | 21,2 |
Приведенные в таблице 1.8 цифры показывают, что наибольший выход аммиака достигается в интервале температур 475-500 °С.
На процесс синтеза аммиака значительное влияние оказывает применяемое при этом давление (см. рисунок 1.5).
1: Р = 10 МПа; 2: Р = 30 МПа; 3: Р = 60 МПа; 4: Р = 100 МПа
Рисунок 1.5 – Зависимость производительности катализатора от объемной скорости и давления
В зависимости от применяемого давления азотоводородной смеси известны следующие системы синтеза аммиака:
1. Системы, работающие при низких давлениях (9-19 МПа).
2. Системы, работающие при средних давлениях (27-31 МПа).
3. Системы, работающие при высоких давлениях (44-98 МПа).
Установки синтеза аммиака, работающие при низких давлениях, аппаратурно громоздки, требуют дополнительных затрат электроэнергии на процесс конденсации аммиака из аммиачно-азотоводородной смеси, поэтому не нашли широкого применения.
Установки синтеза аммиака, работающие при высоких давлениях, также не получили широкого распространения, поскольку требуют сложного конструктивного оформления применяемой аппаратуры.
Наибольшее распространение в мире получили установки, работающие при средних давлениях.
Повышение удельной производительности катализатора (единицы его объема) с увеличением объемной скорости объясняется тем, что содержание аммиака в газовой смеси на выходе из колонны синтеза уменьшается в значительно меньшей степени, чем возрастает объемная скорость. Каждому значению давления соответствует определенная оптимальная объемная скорость газа, превышение которой приводит к увеличению эксплуатационных расходов в производстве аммиака. В промышленности синтез аммиака под давлением 29,43 МПа ведут при объемных скоростях 15000-30000 ч -1 , под давлением 44,12- 49,03 МПа — при объемных скоростях 50000-60000 ч -1 . Выбор объемной скорости также определяется максимальной производительностью единицы реакционного объема колонны синтеза в условиях обеспечения автотермического режима.
При выборе объемной скорости учитывают не только необходимость полнейшего использования катализатора, но и влияние изменения этой скорости на производительность других аппаратов агрегата синтеза аммиака, а также на расход энергии для транспортирования газа, нагревания и охлаждения газовых смесей, выделения жидкого аммиака из газовой смеси.
С увеличением объемной скорости возрастает объем газа, проходящего через аппаратуру для синтеза, и повышается расход энергии и воды. Например, для получения 1 т аммиака при различной объемной скорости через аппараты необходимо пропустить следующие количества газа:
Объемная скорость, ч -1 10 000 20000 40000
Объем газа, м 3 5800 7000 9800.
Расход энергии на циркуляцию азотоводородной смеси через аппаратуру агрегата синтеза аммиака пропорционален объемной скорости, следовательно, он возрастает с увеличением объемной скорости газа.
Из приведенных ранее данных известно, что с повышением давления и понижением температуры степень конденсации аммиака возрастает, а количество его в циркуляционном газе уменьшается. Степень выделения аммиака из газа в значительной мере влияет на производительность установки, так как количество образовавшегося в колонне аммиака соответствует разности его содержания в выходящем и поступающем в колонну газе.
Для достижения максимальной производительности реакционного объема колонны синтеза необходимо наиболее полно сконденсировать аммиак и выделить его из газа. Решить эту задачу можно путем охлаждения газовой смеси после колонны синтеза. Опыт действующих установок и технико-экономические расчеты показали, что наиболее рациональными условиями конденсации аммиака являются следующие:
а) при высоких давлениях (50,7-101,3 МПа) от +20 до +30 °С;
б) при средних давлениях (30,4-32,9 МПа) от -25 до -10 °С;
в) при низких давлениях (10-12 МПа) от -50 до — 45 °С.
При этих условиях содержание аммиака в циркуляционном газе колеблется от 2 до 6 %.
Указанные температуры в условиях высоких давлений могут быть достигнуты при охлаждении газа водой. При средних давлениях применяется аммиачное охлаждение: часть аммиака, получаемого в системе, испаряется для получения низких температур. В условиях низких давлений для получения низких температур (- 45, -50 °С) необходимо также аммиачное охлаждение. В этом случае весь аммиак, получаемый в системе, испаряют. Полученный таким образом газообразный аммиак перерабатывают на удобрения или другие продукты, либо снова переводят в жидкий аммиак.
1.10.3 Технологическая схема установки синтеза аммиака
Учитывая термодинамические и кинетические особенности реакции синтеза аммиака, основой построения циркуляционной схемы синтеза являются следующие принципы:
— организация циркуляционного контура «циркуляционный компрессор – реактор синтеза» с обеспечением постоянного давления в реакторе;
— удаление из системы образовавшегося аммиака;
— введение в циркуляционную систему свежего газа;
— максимально возможная рекуперация тепла экзотремической реакции синтеза и теплп реакций других стадий;
— вывод из системы инертных примесей для обеспечения постоянного состава реагирующего газа.
Технологическая циркуляционная схема синтеза аммиака включает три основные стадии «сжатие (компримирование) синтез-газа – синтез аммиака в реакторе синтеза – выделение аммиака из циркуляционного газа».
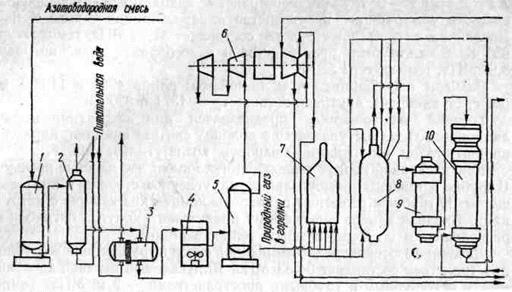
Технологическая схема установки синтеза аммиака представлена на рисунке 1.6. На нижней части рисунка 1.6 технологические линии слева соответствуют технологическим линиям верхней части справа.
После моноэтаноламиновой очистки поступающая свежая азотоводородная смесь проходит два теплообменника, расположенные в цехе конверсии оксида углерода (ІІ) (рисунок 1.6). В первом теплообменнике смесь нагревается от 310 до 370 К теплом парогазовой смеси после абсорбционно-холодильной установки. Во втором теплообменнике газ нагревается до 550-570 К парогазовой смесью после конверсии оксида углерода (ІІ) I ступени. Далее азотоводородная смесь поступает в метанатор 1 с содержанием примесей — СО 0,6-0,8 % об. и СО2 100-300 млн -1 . Здесь газ проходит слой никель-алюминиевого катализатора, при этом в результате протекающих реакций гидрирования при температуре 620 К происходит тонкая очистка азотоводородной смеси до содержания 10-20 млн -1 оксида углерода (ІІ) и 5 млн -1 оксида углерода (ІV).
При необходимости сброс газа происходит через регулятор давления на факельную установку.
Очищенная азотоводородная смесь из метанатора с температурой 620 К поступает в межтрубное пространство подогревателя деаэрированной воды 2, где охлаждается до температуры 400 К, затем проходит межтрубное пространство подогревателя не деаэрированной воды 3, охлаждаясь до температуры 330 К.
Окончательное охлаждение азотоводородной смеси до 313 К и конденсация водяных паров, образовавшихся в результате реакций гидрирования кислородсодержащих веществ, происходит в аппарате воздушного охлаждения 4. После отделения газового конденсата во влагоотделителе 5 газ с давлением 2,5 МПа направляется на всас I ступени центробежного компрессора азотоводородной смеси. После каждой ступени газ проходит холодильники воздушного охлаждения и влагоотделитель. Кроме того, на нагнетании II ступени газ дополнительно охлаждается в аммиачном испарителе. Пройдя последовательно все ступени, газ сжимается до давления 29,5 МПа и направляется в отделение синтеза аммиака.
Рисунок 1.6 — Технологическая схема установки синтеза аммиака производительностью 1360 т/сутки
Во избежание образования карбаматов при увеличении содержания СО2 в газе после метанирования свыше 10 млн -1 предусмотрен впрыск жидкого аммиака, подаваемого насосами в линию нагнетания II ступени. Сконденсировавшийся аммиак вместе с газовым конденсатом через сепаратор III ступени направляется на установку разгонки газового конденсата.
Сжатая до давления 29,5 МПа свежая азотоводородная смесь, направляемая в агрегат синтеза аммиака, имеет следующий состав, % об.: Н2 — 74,12; N2 — 24,5; СН4 — 1,07; Аr — 0,31; СО – 10-20 млн -1 ; СО2 — 5 млн -1 . Эта смесь поступает в сепарационную часть конденсационной колонны 14. Барботируя через слой жидкого аммиака, газ дополнительно промывается от следов влаги и СО2.
В сепарационной части конденсационной колонны свежая азотоводородная смесь смешивается с циркуляционным газом, проходит по трубкам теплообменника конденсационной колонны и с температурой 316 К направляется в выносной теплообменник 10.
Проходя по межтрубному пространству выносного теплообменника, газ нагревается до 450-460 К, охлаждая конвертированный газ, идущий по трубкам, и далее направляется в колонну синтеза 8 (рисунок 1.6).
При пуске системы свежая азотоводородная смесь, смешанная с циркуляционным газом, вначале поступает в пусковой подогреватель с огневым подогревом 7, а затем в колонну синтеза 8.
В колонне синтеза газ проходит снизу вверх вдоль корпусов колонны и теплообменника, размещенного на горловине, и поступает в межтрубное пространство теплообменника. Здесь газ нагревается теплотой конвертированного газа до температуры начала реакции (690-710 К). Затем он последовательно проходит в колонне четыре полки катализатора. Для поддержания нормального температурного режима перед каждой полкой конвертированный газ смешивается с холодным байпасным газом.
Пройдя четвертый слой катализатора, газ с температурой 770-790 К поднимается по центральной трубе и поступает в трубное пространство теплообменника, где охлаждается до температур 600-620 К и выходит из колонны.
Далее газовая смесь поступает в трубки подогревателя воды 9, отдавая свою тепло для нагревания питательной воды от температуры 375 К до 573 К. После подогревателя газ с температурой 488 К проходит трубное пространство выносного теплообменника 10, затем с температурой 340-343 К поступает в аппараты воздушного охлаждения 11. В последних из охлажденного газа конденсируется часть аммиака.
Сконденсировавшийся аммиак отделяется в сепараторе 12, а газовая смесь с температурой 313 К и давлением 28,53 МПа направляется на всасывание циркуляционного устройства, расположенного в третьем корпусе компрессора 6, где дожимается до 31,88 МПа, компенсируя потери давления в системе.
После циркуляционного устройства газовая смесь поступает в конденсационную колонну 14, проходит межтрубное пространство теплообменника, охлаждаясь до 291-293 К встречным потоком холодного газа, идущего из аммиачных испарителей 15. Далее газ поступает в испарители 15, где, проходя по трубкам высокого давления, охлаждается до температур около 270 К.
В конденсационной колонне и испарителях происходит окончательная конденсация аммиака из газа. В межтрубном пространстве испарителей кипит жидкий аммиак при температуре 263 К.
Из испарителей смесь охлажденного газа и сконденсировавшегося аммиака поступает в сепарационную часть конденсационной колонны, где происходит отделение сконденсировавшегося аммиака от газа. Затем, после смешения со свежим газом, газовый поток проходит корзину с кольцами Рашига, где дополнительно сепарируется от капель аммиака, поднимается по трубкам теплообменника и направляется в выносной теплообменник.
Жидкий аммиак, отделившийся в сепараторе 12, проходит фильтр жидкого аммиака 13, где очищается от катализаторной пыли, далее дросселируется до 4 МПа и отводится в сборник жидкого аммиака 19. Жидкий аммиак, отделившийся в конденсационной колонне, дросселируется до 4 МПа и отводится в сборник 19.
В результате дросселирования в сборнике жидкого аммиака с 29,5 до 4 МПа происходит выделение растворенных в жидком аммиаке газов (Н2, N2, CH4, Аr). Эти газы, называемые танковыми, содержат около 17 % NH3.
Выделение аммиака из танковых газов происходит в испарителе 17 за счет охлаждения газов испаряющимся жидким аммиаком до температуры 255 К. Сконденсировавшийся аммиак отделяется в сепараторе 18, откуда поступает в сборник 19, а танковые газы дросселируются до 1,1-1,8 МПа и направляются в агрегат конверсии метана для сжигания в трубчатых печах.
Для поддержания в агрегате количества инертных примесей на определенном уровне производят постоянную продувку после сепаратора жидкого аммиака 12.
Продувочные газы под давлением 29,5-32 МПа направляются на вымораживание аммиака. Они поступают в межтрубное пространство теплообменника конденсационной колонны продувочных газов 21, охлаждаются за счет теплообмена с газом, идущим из испарителя 16, проходят испаритель 16 и с температурой 247 К возвращаются в конденсационную колонну. В сепарационной части конденсационной колонны происходит отделение сконденсировавшегося аммиака, а газовая смесь поднимается по трубкам теплообменника, нагреваясь вновь поступающими продувочными газами до температуры 308 К.
Отделившийся жидкий аммиак направляется в сборники 19.
Далее продувочные газы смешиваются с танковыми газами и направляются в агрегат конверсии метана для сжигания в трубчатых печах.
Для сбора дренажей установлена промежуточная дренажная емкость 20, откуда выдается аммиачная вода на склад жидкого аммиака в специально предусмотренный сосуд для аммиачной воды.
Флегма из испарителя 15 направляется в теплоиспользующую абсорбционно-холодильную станцию с температурой 263 К.
Газообразный аммиак из межтрубного пространства испарителя 15б идет на переработку. Давление газообразного аммиака составляет около 0,3 МПа. Жидкий аммиак подается в этот испаритель из сборника 19. Газообразный аммиак из испарителя танковых и продувочных газов при температуре 303 К направляется в газгольдер. Жидкий аммиак подается в эти испарители из сборников 19 или со склада.
Из сборников 19 жидкий аммиак с температурой около 285 К после дросселирования до 1,8 МПа направляется на склад.
1.10.4 Перспективы развития производства синтетического аммиака
На различных стадиях производства синтетического аммиака из природного газа можно выделить следующие перспективные направления:
1) Применение мембранного разделения газовых смесей на стадии очистки природного газа от соединений серы;
2) Усовершенствование риформинга природного газа с использованием для сжигания продувочных и танковых газов; с более глубоким использованием низко потенциального тепла дымовых газов; с использованием при конверсии природного газа воздуха, обогащенного кислородом;
3) Разработка новых и усовершенствование действующих катализаторов конверсии оксида углерода (ІІ) с одновременным повышением уровня их защиты от действия катализаторных ядов;
4) Поиск новых абсорбентов диоксида углерода из конвертированного газа; внедрение технологий очистки ретурного газа от водорода;
5) Усовершенствование технологии синтеза аммиака в направлениях кооперации производства аммиака с производствами основного органического синтеза; утилизации продувочных и танковых газов; внедрения мембранной технологии извлечения водорода из отходящих газов; использования бицикличных схем синтеза; применения новых конструкций аппаратов (в частности, колонн синтеза с кипящим слоем катализатора); создания агрегатов большей единичной мощности; разработки новых высокоэффективных при низких давлениях катализаторов с низкой температурой зажигания.
💡 Видео
Аммиак. 9 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Аммиак. Химия 9 классСкачать

Практическая работа №4 Получение аммиака и изучение его свойствСкачать

Аммиак за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Азот: свойства и применение. Аммиак. Физические и химические свойства. Получение и применение.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

9 класс § 30 "Аммиак. Соли аммония".Скачать

Реакция аммиака с раствором сульфата меди. Химия азота для ЕГЭ по химииСкачать

Опыты по химии. Получение и собирание аммиакаСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Самые удивительные химические реакцииСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение аммиакаСкачать