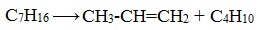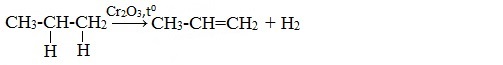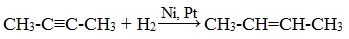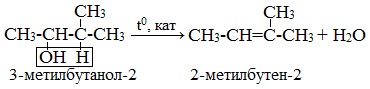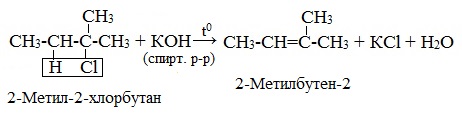Пропанол-1, пропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение пропанола-1
- Водородные связи и физические свойства спиртов
- Изомерия пропанола-1
- Структурная изомерия
- Химические свойства пропанола-1
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- СН3–CH2–CH2–OK + H2O → СН3–CH2–CH2–OH + KOH
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление спиртов
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование спиртов
- Получение пропанола-1
- 1. Щелочной гидролиз галогеналканов
- 2. Гидрирование карбонильных соединений
- Уравнение реакции получения алкенов из пропилового спирта
- Школе NET
- Register
- Login
- Newsletter
- Энджелл
- напишите уравнения реакций получения пропилена из:а)пропана;б)пропилового спирта СH3-CH2-Ch2OH
- Лучший ответ:
- Суррикат Мими
- 🔥 Видео
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Строение пропанола-1
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол смешивается с водой в любых соотношениях.
Видео:2.2. Алкены: Способы полученияСкачать

Изомерия пропанола-1
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Структурная изомерия
Для пропанола-1 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Видео:МАГИЯ в Химии — Способы Получения АлкеновСкачать

Химические свойства пропанола-1
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-1
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-1 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-1 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-1 взаимодействует с калием с образованием пропилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, пропилат калия разлагается водой: |
СН3–CH2–CH2–OK + H2O → СН3–CH2–CH2–OH + KOH
Видео:Способы получения алкадиенов | Химия ЕГЭ для 10 класса | УмскулСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-1 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии пропанола-1 с аммиаком образуется пропиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, пропанол-1 реагирует с уксусной кислотой с образованием пропилацетата (пропилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии пропанола-1 с азотной кислотой образуется пропилнитрат. |
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-1 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-1 при низкой температуре образуется дипропиловый эфир: |
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов.
| Например, пропанол-1 окисляется оксидом меди до пропионового альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов.
| Например, при окислении пропанола-1 образуется пропаналь |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии пропанола-1 с перманганатом калия в серной кислоте образуется пропионовая кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания пропанола-1: |
Видео:Получение алкенов. 10 класс.Скачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании пропанола-1 образуется пропаналь. |
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Получение пропанола-1
Видео:Углеводороды: алкены. Химические свойства и получение | Химия ЕГЭ, ЦТСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 1-хлорпропана с водным раствором гидроксида натрия образуется пропанол-1 |
Видео:Химические свойства алкенов | Химия 10 класс | УмскулСкачать

2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты.
Видео:3.2. Алкины: Способы полученияСкачать

Уравнение реакции получения алкенов из пропилового спирта
В промышленности
В природе алкены встречаются в меньшей степени, чем предельные углеводороды, вследствие своей высокой реакционной способности. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, поэтому их получают с использованием различных реакций.
1.Крекинг алканов
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400 о -700 о С).
2.Дигидрирование алканов (отщепление молекул водорода)
Реакция проводится при температуре 400 0 С, катализатором является оксид хрома (III) или Ni.
3.Гидрирование алкинов (присоединение молекул водорода)
В лаборатории
Алкены получают по реакциям отщепления (элиминирования) двух атомов или групп атомов от соседних атомов углерода с образованием между ними π-связи.
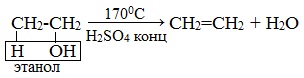
1. Дегидратация спиртов (отщепление молекул воды)
Этилен получают при нагревании этилового спирта в присутствии концентрированной серной кислоты, как сильного водоотнимающего вещества при нагревании и недостатке спирта:
При внутримолекулярной дегидратация вторичных и третичных спиртов атом водорода отрывается от менее гидрогенизированного соседнего атома углерода (правило А.М.Зайцева).
Видеоопыт «Получение этилена из этилового спирта»
Видеоопыт «Получение этилена и опыты с ним»
2. Дегидрогалогенирование моногалогеналканов действием спиртового раствора щелочи (происходит по правилу Зайцева)
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов (Mg, Zn)
Видео:Химические свойства алкеновСкачать

Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 16201646
Энджелл
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

напишите уравнения реакций получения пропилена из:а)пропана;б)пропилового спирта СH3-CH2-Ch2OH
Видео:Как написать уравнения реакции полимеризации?Скачать

Лучший ответ:
Суррикат Мими
1)Дегидрирование
СН3-СН2-СН3 -> СН3-СН=СН2 Н2 Условие: Терпература, никелевый катализатор
2)CH3-CH2-CH2OH (t, H2SO4 конц) = H2O CH3-CH=CH2 (пропилен)
🔥 Видео
7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

Алкадиены. Получение алкадиенов. 10 класс.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

2.3. Алкены: Химические свойстваСкачать

65. Что такое реакция гидратации и реакция дегидратацииСкачать