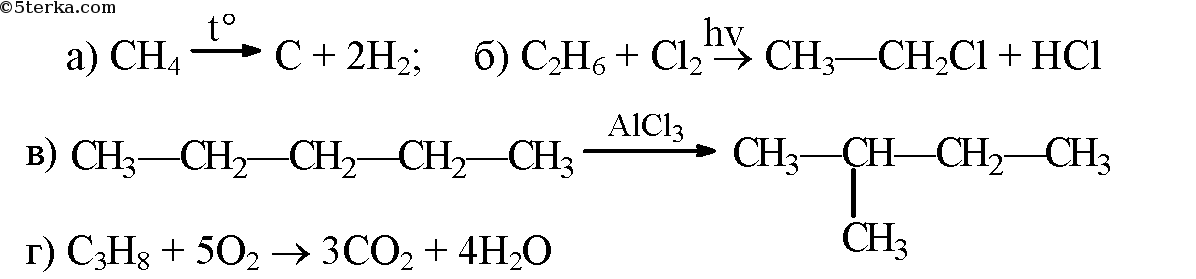При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- 2. Напишите уравнения реакций: а) термического разложения метана; б) первой стадии хлорирования этана; в) изомеризации пентана (укажите условия протекания реакции); г) горения пропана в кислороде.
- 2. Напишите уравнения реакций: а) термического разложения метана; б) первой стадии хлорирования этана; в) изомеризации пентана (укажите условия протекания реакции); г) горения пропана в кислороде.
- Классификация реакций разложения
- 💥 Видео
Видео:Уравнивание реакций горения углеводородовСкачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение солей
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Реакции разложения. Как понять?Скачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Разложение перманганата калия
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

2. Напишите уравнения реакций: а) термического разложения метана; б) первой стадии хлорирования этана; в) изомеризации пентана (укажите условия протекания реакции); г) горения пропана в кислороде.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

2. Напишите уравнения реакций: а) термического разложения метана; б) первой стадии хлорирования этана; в) изомеризации пентана (укажите условия протекания реакции); г) горения пропана в кислороде.

задача №2
к главе «Тема II. Предельные углеводороды (алканы, или парафины). Работа 2 Изомерия, получение и химические свойства алканов. Вариант 2».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Классификация реакций разложения
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Реакции разложения
Термин разложение применительно к химическому процессу обычно означает разрушение одной или нескольких составных частей реагента на более простые атомные группировки. Термин термическое разложение или термолиз, подразумевает, что такая перестройка обусловлена повышением температуры.
Таким образом, термическое разложение твердых веществ — все процессы, вызывающие уменьшение стабилизирующих сил, связывающих кристаллическую решетку реагирующего твердого тела, включая как химические реакции, так и физические превращения (например, плавление, сублимация и рекристаллизация). Однако на практике это определение обычно используется в более узком смысле и обычно применяется к тем процессам, в которых в результате перераспределения связей образуется твердый остаток, отличающийся по химическим свойствам от исходного реагента.
Термическое разложение твердого тела можно представить в виде:
А (тв.) = В (тв.) + С (г.),
где А — реагент, В и С — продукт или продукты, а «тв.» и «г.» обозначают соответственно твердую и газообразную фазы.
Взаимодействие между твердыми телами можно записать как:
А (тв.) + D (тв.) = Продукты,
причем продукты могут быть твердыми, жидкими или газообразными.
Рис. 1 — Типичные кривые процессов термического разложения
Разложение может протекать медленно или очень быстро (взрыв). Кинетические кривые, описывающие такие реакции, могут иметь различную форму; некоторые из них показаны на рис. 1. Многие медленно протекающие процессы описываются S-образной кривой (рис. 1, б). Начальный участок такой кривой соответствует периоду постепенного ускорения процесса, в ходе которого происходит образование и рост зародышей продукта реакции. Достигнув определенного размера, ядра начинают перекрываться; это приводит к сокращению поверхности раздела между исходным веществом и продуктом реакции и тем самым к уменьшению скорости процесса. При разложении некоторых веществ, например азидов свинца и серебра, индукционный период отсутствует; и процесс начинается с максимальной скоростью. Обычно индукционный период можно уменьшить (или совсем исключить) растиранием или дроблением образца, так как это приводит к увеличению поверхности и образованию дислокаций, а, следовательно, облегчает образование зародышей. Однако такая обработка не сказывается на последующем протекании процесса.
Термическое разложение твердого тела, неизбежно содержащее химическую стадию, иногда связано с физическими превращениями — плавлением, сублимацией и рекристаллизацией. Различные аспекты взаимосвязи физических превращений с реакциями разложения твердых тел рассмотрены в работе [книга Будникова и Гинстлинга]. Фазовые изменения оказывают, как правило, значительное влияние на сопутствующие или последующие химические процессы, поэтому целесообразно рассмотреть характерные свойства, присущие плавлению, сублимации и рекристаллизации, которые могут иметь значение при рассмотрении реакций термического разложения.
Плавление. Потеря кристаллического состояния твердым реагентом в результате плавления, образования эвтектики или растворения в продукте часто приводит к увеличению скорости разложения вследствие релаксации сил связи, ответственных за стабильность решетки. Появление жидкой фазы во время разложения твердых реагентов (например, в случае нитратов металлов, оксихлоридов и органических веществ) нередко сопровождается увеличением скорости образования продукта. При обсуждении результатов реакций термического разложения твердых тел необходимо также рассматривать возможное плавление и роль образующейся жидкой фазы.
Общепринятой исчерпывающей теории плавления на сегодняшний день не существует. Характерная особенность процесса плавления, имеющая обычно важное теоретическое значение, — это невозможность твердого, тела находиться в перегретом состоянии. Исключений из этого правила известно очень мало [2]. Почти всегда жидкая фаза начинает образовываться сразу же при достижении температуры плавления. В этом отношении плавление резко отличается от обратного процесса — кристаллизации, поскольку при соответствующих условиях большинство жидкостей может находиться в переохлажденном состоянии.
Как отмечается в обзоре Уббелоде [3], свойства твердых тел, а также жидкостей (продуктов) в окрестности точки плавления практически не изучены. В одной из первых работ по теории плавления Линдеманн [4] предполагал, что кристаллическая решетка теряет стабильность, если амплитуда колебания атомов твердого тела достигает по мере увеличения температуры некоторой доли периода решетки (вероятно, 10%). Энергия, необходимая для перестановки элементов решетки — атома в узле с атомом, внедренным в междоузлие, — рассматривается в теории Леннарда-Джонса—Девоншира [5]. Дальнейшее развитие этих моделей и многочисленные работы в этой области обсуждаются в книге Уббелоде [3].
Кристиан [6] рассматривает плавление как процесс образования и роста зародышей. Он обсуждает возможность того, что таким зародышем может являться поверхность твердого тела: дефекты решетки или примесные включения также могут способствовать образованию расплава. Таким образом, процесс плавления — это всегда двухфазное явление, и, следовательно, любая теоретическая интерпретация должна быть основана на предположении о взаимодействии между фазами, различающимися по степени упорядоченности.
Кюльманн-Вилсдорф [7] предложил новое теоретическое объяснение, согласно которому плавление рассматривается как неограниченное размножение дислокаций при такой температуре, когда свободная энергия образования ядер дислокаций скольжения становится отрицательной. Среди физиков к этой модели был проявлен интеpec, тогда как в химической литературе ей не было уделено должного внимания.
Теория плавления продолжает оставаться объектом обсуждений в недавних работах, в которых рассматривались концентрации вакансий вблизи температуры плавления [8, 9], решеточные колебания и тепловое расширение [8, 10—12]. Между тем плавление продолжает также оставаться объектом и экспериментальных исследований. Кокер и др. [13], исследуя плавление тетра-п-амил-тиоцианата аммония, нашли, что при плавлении этого соединения происходят структурные изменения, не менее существенные, чем при фазовом переходе, который предшествует плавлению. Они предположили, что твердое и расплавленное состояния соли обладают близкими структурами, а существующие различия определяются возможностью углеводородных цепей скручиваться и раскручиваться после плавления. При достижении точки плавления проводимость твердого тела возрастает. Вблизи температуры плавления (ΔТ
4К) Олнэт и Сайм [14] обнаружили аномально большое увеличение проводимости хлорида натрия. В рамках общей теории разупорядочения в пластических кристаллах Кларк и др. [15] рассмотрели переходы, предшествующие плавлению.
Как и в случае других свойств твердого тела, для очень маленьких кристаллов (микроскопического размера) возрастает относительный вклад поверхностной энергии, что влияет на температуру плавления [2, 16, 17], а также па диффузию при этой температуре. Поскольку твердое тело не может находиться в перегретом состоянии, провести количественное изучение скорости плавления невозможно. Скорость эндотермического фазового превращения определяется тепловым потоком и теплопроводностью твердого тела;
Сублимация. При сублимации элементы решетки твердого тела, минуя жидкую фазу, переходят непосредственно в газ, хотя не исключено, что на поверхности нагретого твердого тела может существовать промежуточная подвижная фаза. Некоторые особенности сублимации описаны Соморджаем [18] и Розенблаттом [19]. В этих же работах рассмотрены и кинетические аспекты. Процессы диффузии па поверхности обсуждены Ридом [20].
Рекристаллизация. В результате рекристаллизации твердого тела может образоваться высокотемпературная модификация решетки, в которой один или несколько элементов имеют большую свободу движения, например, нecфеpичecкий элемент получает возможность вращаться. Предполагается [3], что такие превращения предшествуют процессу плавления. Механизмы фазовых переходов рассмотрены в обзорах Нагеля и О’Киффи [21], а также Хеннея [22].
Рекристаллизация может также приводить к исчезновению областей локального искажения решетки, например, дислокаций, границ раздела и т. д., без изменения в химическом составе или даже без изменения конфигурации решетки; такой пример описан Кристианом [6]. При наличии двух фаз некоторые частицы дисперсной фазы могут расти за счет других (более мелких или менее совершенных) кристаллитов, уменьшая тем самым суммарную поверхностную энергию [23, 24]. Реакции с выпадением в осадок новой фазы из пересыщенного раствора имеют огромное практическое значение, например образование карбида в металлургии железа [25] и кристаллизация стекол [1246].
Классификация реакций разложения
Отнесение того или иного случая термического распада органических веществ к конкретному виду реакций термического разложения зависит от механизма первичных стадий термического распада, который в случае многих реакций остается неясным. Поэтому важнейшей задачей изучения термического разложения твердых веществ, вообще, и твердых органических веществ, в частности, является изучение элементарных стадий в начальном периоде процесса с использованием современных физических и физико-химических методов.
Существуют две группы реакций термического разложения. Одно и то же вещество в зависимости от условий может разлагаться по различным типам химического механизма. Так, распад перхлората аммония по Биркомшоу и Ньюмену [31] при высоких температурах идет через отщепление протона от катиона аммония, поэтому эту реакцию следует отнести к первой группе:
Распад карбонатов также относится к первой группе реакций.
При низких температурах энергии тепловых квантов не хватает для возбуждения достаточно сильных колебаний протона в аммонийном катионе, вместо этого происходит возбуждение электрона в перхлорат-ионе, и основной элементарной стадии процесса термического распада является переход электрона от перхлорат-иона к катиону аммония, поэтому это термическое разложение перхлората аммония относится ко второй группе:
💥 Видео
Реакции разложенияСкачать

8 класс. Составление уравнений химических реакций.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать