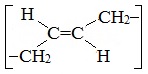
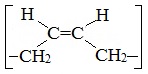
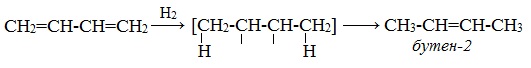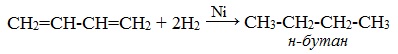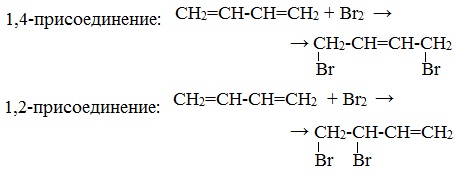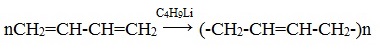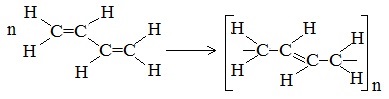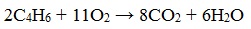Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
- Химические свойства сопряженных алкадиенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкадиенов
- 1.3. Гидрогалогенирование алкадиенов
- 1.5. Полимеризация
- 2. Окисление алкадиенов
- 2.1. Мягкое окисление алкадиенов
- 2.2. Жесткое окисление
- 2.3. Горение алкадиенов
- Алкадиены
- Уравнение реакции полного гидрирования пропадиена
- Реакции присоединения
- 🔥 Видео
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
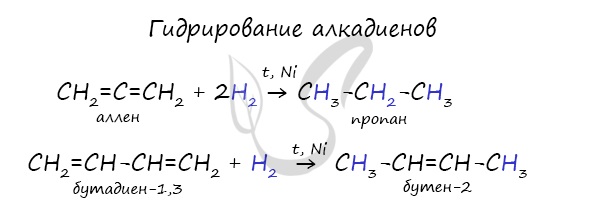
1.1. Гидрирование
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
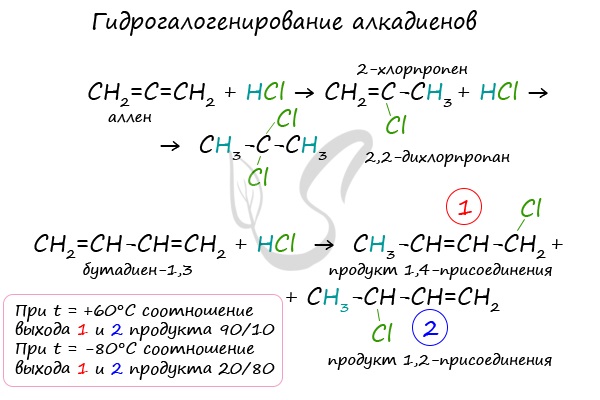
1.3. Гидрогалогенирование алкадиенов
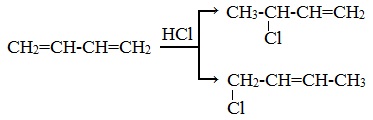
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
Видео:Уравнивание реакций горения углеводородовСкачать

2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Алкадиены
Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2. Общая формула их гомологического ряда — CnH2n-2.
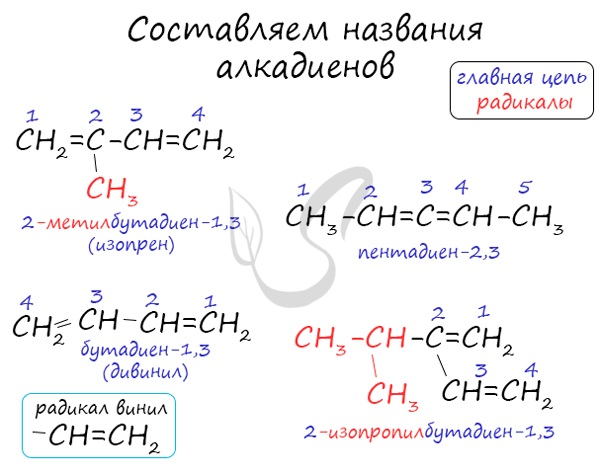
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
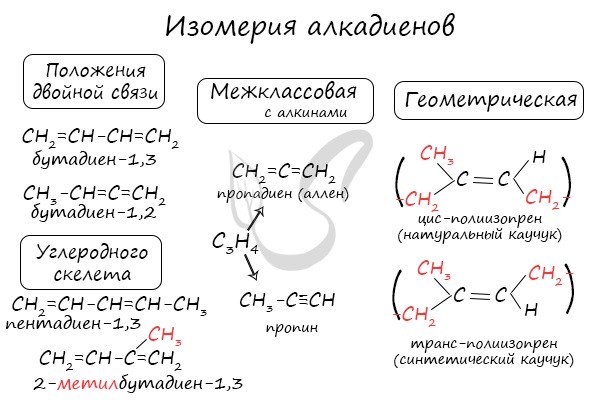
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена крайние атомы углерода находятся в состоянии sp 2 -гибридизации, а центральный атом — sp-гибридизации.
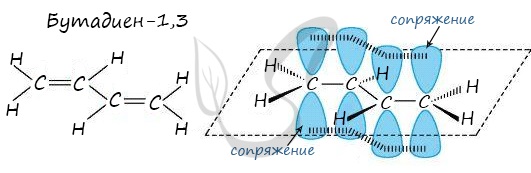
Сопряженные двойные связи
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
Изолированные двойные связи
В случае, если две двойные связи разделены двумя и более одинарными связями.
Получение алкадиенов
Алкадиены получают несколькими способами:
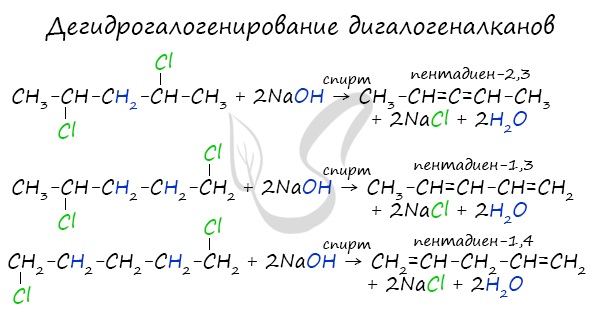
- Дегидрогалогенирование дигалогеналканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.
Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3 при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Уравнение реакции полного гидрирования пропадиена
Наибольшее значение имеют диены с сопряженными связями, так как они являются сырьем для получения каучуков. В химическом поведении этих диенов есть особенности, обусловленные наличием в их молекулах сопряжения. Для них характерны реакции присоединения по концам системы
сопряжённых связей и образование двойной связи между срединными атомами углерода (1,4-присоединение) или к одной из двойных связей (1,2-присоединение).
Реакции присоединения
1. Гидрирование
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3:
В присутствии катализатора Ni получается продукт полного гидрирования:
2. Галогенирование
При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
Обесцвечивание бромной воды является качественной реакцией на кратную связь.
3. Гидрогалогенирование
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах).
4. Реакции полимеризации
Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков.
Полимеризация 1,3-диенов может протекать либо по типу 1,4-присоединения, либо по смешанному типу 1,2- и 1,4-присоединения. Направление присоединения зависит от условий проведения реакции.
При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук (полибутадиен).
Избирательное 1,4-присоединение происходит при использовании металлорганических катализаторов (например, бутиллития C4H9Li, который не только инициирует полимеризацию, но и определенным образом координирует в пространстве присоединяющиеся молекулы диена):
В упрощенном виде реакцию полимеризации бутадиена-1,3 по схеме 1,4 присоединения можно представить следующим образом:
Элементная ячейка полибутадиена представляется следующим образом:
Как видно, образующийся полимер характеризуется транс-конфигурацией элементной ячейки полимера. Однако наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме 1,4-присоединения с образованием цис-конфигурации полимерной цепи.
Например, цис-полибутадиен:
5. Горение (полное окисление)
Как и все углеводороды алкадиены сгорают до углекислого газа и воды.
6. Диеновый синтез (реакция Дильса-Альдера)
В органическом синтезе широко применяется реакция присоединения к сопряженным диенам соединений, содержащих кратные связи (так называемых диенофилов). Реакция идет как 1,4-присоединение и приводит к образованию циклических продуктов:
🔥 Видео
6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидрируем и дегидрируем углеводородыСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

65. Что такое реакция гидратации и реакция дегидратацииСкачать

6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

Органическая химия Углеводород Пропан Циклопропан Дегидрирование Гидрирование 10 класс ЕГЭ ВидеоурокСкачать

Решаем задание С5 из ЕГЭ 2015 года.Скачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Составление уравнений реакций горения. 11 класс.Скачать

Химические свойства алканов. 1 часть. 10 класс.Скачать