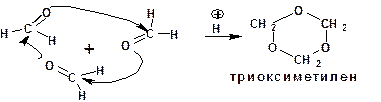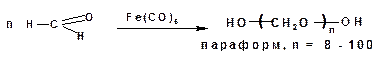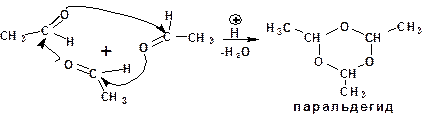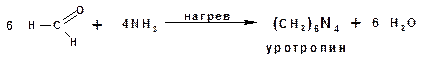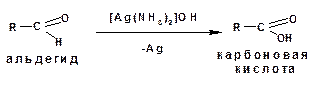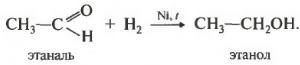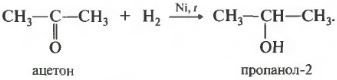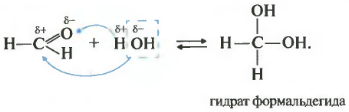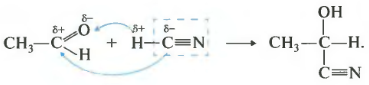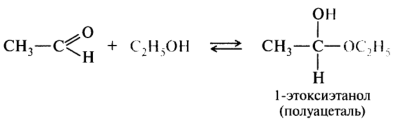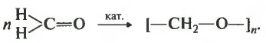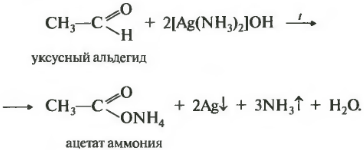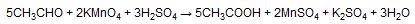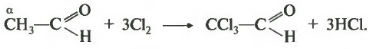Применение кислоты в качестве катализатора и атака уг-лерода карбонильной группы атомом кислорода карбонильной группы второй молекулы альдегида характерны для реакций полимеризации альдегидов.
Например, формальдегид, будучи при нормальных усло-виях газом, под влиянием разбавленных кислот образует цикли-ческий кристаллический тример, называемый триокси-метиленом:
При пропускании газообразного формальдегида над карбонилом железа образуется высокомолекулярный полиформ-альдегид или параформ:
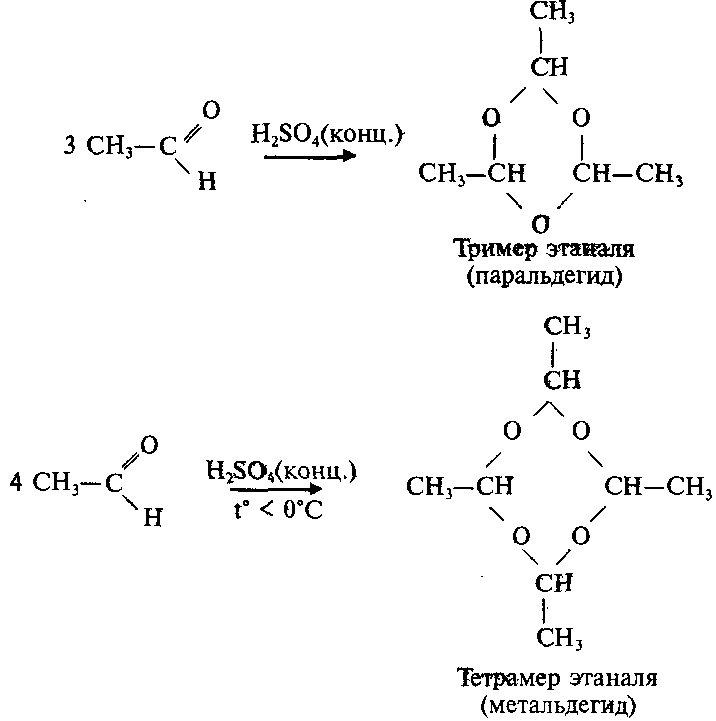
В условиях кислотного катализа уксусный альдегид тримеризуется с образованием циклического паральдегида:
Механизм реакции предусматривает протонирование атома кислорода карбонильной группы одной молекулы альде-гида, что приводит к образованию карбкатиона. Последний повергается атаке атомом кислорода другой молекулы альдегида.
К числу реакций полимеризации можно отнести реакцию формальдегида с аммиаком:
Окисление
Определение. Раствор аммиаката серебра называют реактивом Толленса.
Водно-щелочной раствор, комплексной соли меди с винной кислотой, получаемый смешением гидроокиси меди с натрий-калиевой солью винной кислоты, называют фелинговой жидкостью.
Альдегиды легко окисляются до карбоновых кислот реактивом Толленса. Образующееся в результате восстановления металлическое серебро, выделяется осадком в виде зеркального покрытия:
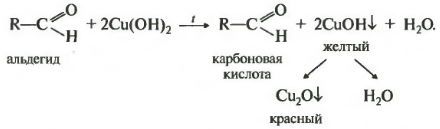
Для окисления альдегидов также часто используется фелингова жидкость. При нагревании альдегидов с фелинговой жидкостью медь (II) восстанавливается до меди (I). При этом выделяется красный осадок закиси меди.
Кроме того, окисление альдегидов можно проводить холодным разбавленным раствором перманганата калия, хро-мовой кислотой, пероксидом водорода.
Окисление кетонов протекает в жестких условиях с разрывом углеродной цепи и образованием смеси карбоновых кислот:
Видео:№ 82. Органическая химия. Тема 16. Альдегиды. Часть 7. Реакции конденсации, полимеризации альдегидовСкачать

Химические свойства
- Строение, номенклатура, изомерия
- Способы получения
- Химические свойства
1. Реакции присоединения к альдегидам и кетонам
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.
У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.
Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты, наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.
Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.
Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.
И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
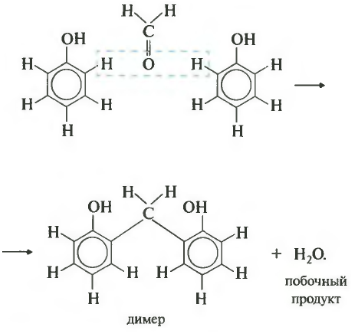
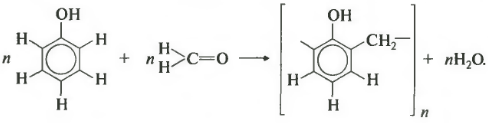
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.
В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.
Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.
Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.
Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO2, проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Видео:Реакция полимеризации. 9 класс.Скачать

Альдегиды
Альдегиды являются представителями карбонильных соединений.
Карбонильные соединения (оксосоединения) – это производные УВ, содержащие в молекуле карбонильную группу С = О.
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
В зависимости от характера углеводородного радикала, связанного с альдегидной группой, альдегиды разделяются на предельные, непредельные и ароматические.
Предельные (насыщенные) альдегиды
Гомологический ряд
Номенклатура и изомерия
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
В пределах класса альдегидов возможен только один вид изомерии – изомерия углеродной цепи.
Физические свойства
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8—12 атомов «С», — душистые вещества. Альдегиды с 1—3 атомами «С» хорошо растворяются в воде; с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства
Альдегиды — один из наиболее реакционноспособных классов органических соединений, что связано с наличием в их молекулах высокополяризованной карбонильной группы >С=О.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
I. Реакции присоединения
1.Гидрирование (восстановление) с образованием первичных спиртов RCH2ОH:
2.Присоединение спиртов с образованием полуацеталей:
Гидроксильная группа полуацеталей очень реакционноспособна.
В присутствии катализатора – хлороводорода и при избытке спирта образуются ацетали RCH(OR)2:
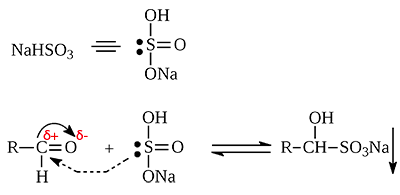
3.Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов:
Этой реакцией часто пользуются для выделения альдегидов из смесей или с целью их очистки.
II. Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: О2 воздуха, подкисленный раствор K2Cr2O7 или КМnО4, слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.):
Реакции с аммиачным раствором оксида серебра (I) и щелочным раствором сульфата меди (II) являются качественными реакциями на альдегиды.
1.Взаимодействие с аммиачным раствором оксида серебра (I) — «реакция серебряного зеркала».
Оксид серебра (I) образуется в результате взаимодействия нитрата серебра(I) с NH4ОH:
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
2.Взаимодействие с гидроксидом меди (II)
Для реакции используют свежеприготовленный Cu(OH)2 образующийся при взаимодействии растворимой соли меди (II) со щелочью:
III. Реакции полимеризации (характерны для низших альдегидов)
1.Линейная полимеризация
При испарении или длительном стоянии раствора формальдегида происходит образование полимера— параформальдегида:
Полимеризация безводного формальдегида в присутствии катализатора — пентакарбонила железа Fe(CO)5 — приводит к образованию высокомолекулярного соединения— полиформальдегида (полиоксиметилен, полиметиленоксид):
2.Циклическая полимеризация (тримеризация, тетрамеризация)
Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Уксусный альдегид образует циклические триммер и тетрамер:
IV. Реакции поликонденсации
Реакции поликонденсации — это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н2О, НCl, NH3 и др.
В кислой или щелочной среде при нагревании формальдегид (образует с фенолом высокомолекулярные продукты — фенолформальдегидные смолы различного строения:
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолоспирта:
При нагревании фенолоспирты конденсируются с образованием фенолформальдегидных полимеров:
Фенолформальдегидные смолы используются для получения пластических масс (фенопластов).
Способы получения
I. Общие методы получения
1.Окисление первичных спиртов:
б) под действием окислителей (K2Cr2O7 или KMnO4 в кислой среде)
2.Каталитическое дегидрирование первичных спиртов:
3.Гидролиз дигалогеналканов, содержащих 2 атома галогена у первого атома углеродного атома:
II. Специфические способы получения
Формальдегид можно получить при каталитическом окислении метана:
Ацетальдегид получают реакцией Кучерова:
или при каталитическом окислении этилена:
Данный способ в последнее время широко используется для промышленного получения ацетальдегида. Однако аналогично могут быть получены и другие альдегиды при окислении гомологов этилена, например:
Скачать бесплатно реферат на тему: «Альдегиды» Альдегиды.docx (248 Загрузок)
Скачать бесплатно реферат на тему: «Альдегиды и кетоны» Альдегиды-и-кетоны.docx (238 Загрузок)
Скачать рефераты по другим темам можно здесь
📸 Видео
Как написать уравнения реакции полимеризации?Скачать

Реакция полимеризации. 1 часть. 11 класс.Скачать

РЕАКЦИЯ АЛЬДЕГИДОВ СО СПИРТАМИСкачать

Качественная реакция на альдегиды с гидроксидом медиСкачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

78. Что такое реакции полимеризацииСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать

АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯСкачать

Качественная реакция на альдегиды с гидроксидом меди IIСкачать

Реакция полимеризации. Производство полиэтилена. 10 класс.Скачать

Опыты по химии. Окисление спирта в альдегидСкачать

Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать

Полимеры. Ч.3-5. Катионный механизм реакции полимеризации алкенов.Скачать

79. Что такое реакции поликонденсацииСкачать

Эксперимент «Полимеризация»Скачать

Полимеры. Ч.3-3. Полимеризация этилена (элементарно о реакции)Скачать

Альдегиды строение, свойства | Химия 10 класс #28 | ИнфоурокСкачать

10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать